Перейти к:
Систематический обзор с метаанализом и непрямым сравнением результатов исследований по оценке эффективности и безопасности применения цефтобипрола и цефтаролина у взрослых пациентов в терапии инфекций различных локализаций
https://doi.org/10.37489/2782-3784-myrwd-073
EDN: CNBYJS
Аннотация
Цель исследования. Сравнить эффективность и безопасность цефалоспоринов V поколения (цефтаролина фосамила и цефтобипрола) при применении у взрослых пациентов в терапии инфекций различной локализации.
Материалы и методы. Проведён систематический обзор литературы с метаанализом и непрямым сравнением результатов исследований по оценке эффективности и безопасности применения цефтобипрола и цефтаролина у взрослых пациентов в терапии внебольничной пневмонии, а также инфекций кожи и мягких тканей по следующим исходам: частота клинического излечения, частота микробиологической эрадикации, летальность, частота развития серьёзных нежелательных явлений (СНЯ), частота нежелательных явлений (НЯ), по мнению исследователей, связанных с приёмом исследуемого препарата (ИП), а также частоты диареи с расчётом отношения шансов (ОШ) развития каждого из событий.
Результаты. В систематический обзор включено 12 рандомизированных клинических исследований. В лечении внебольничной пневмонии цефтобипрол был также эффективен в отношении клинического излечения, летальности и микробиологической эрадикации как цефтаролин и комбинация цефтриаксон с линезолидом или без него. В лечении осложнённых инфекций кожи и мягких тканей цефтобипрол был сопоставим с цефтаролином и комбинацией бета-лактам и ванкомицин в отношении клинического излечения и летальности. В отношении частоты достижения микробиологической эрадикации цефтобипрол был сопоставим с комбинацией бета-лактам и ванкомицин и превосходил по данному показателю цефтаролин (ОШ 1,65; 95 % ДИ 1,11; 2,44, р = 0,01). В лечении инфекций нижних дыхательных путей, осложнённых инфекций кожи и мягких тканей, а также бактериемии цефтобипрол был также безопасен в отношении частоты развития СНЯ (ОШ = 0,93; 95 % ДИ 0,71;1,22; р = 0,63) и частоты развития диареи (ОШ 1,23; 95 % ДИ 0,93; 1,64; p = 0,13) как и цефтаролин.
Выводы. Цефтаролина фосамил и цефтобипрол сопоставимы в эффективности и безопасности при лечении пациентов с внебольничной пневмонией и осложнёнными инфекциями кожи и мягких тканей. В группе пациентов с нозокомиальной пневмонией только цефтобипрол был доказанно эффективен в отношении снижения летальности в сравнении с комбинацией цефтазидим и линезолид.
Ключевые слова
Для цитирования:
Гомон Ю.М., Петриченко А.С. Систематический обзор с метаанализом и непрямым сравнением результатов исследований по оценке эффективности и безопасности применения цефтобипрола и цефтаролина у взрослых пациентов в терапии инфекций различных локализаций. Реальная клиническая практика: данные и доказательства. 2025;5(2):40-57. https://doi.org/10.37489/2782-3784-myrwd-073. EDN: CNBYJS
For citation:
Gomon Yu.M., Petrichenko A.S. A systematic review with meta-analysis and indirect comparison of the results of studies evaluating the efficacy and safety of ceftobiprole and ceftaroline in adult patients in the treatment of infections of various localizations. Real-World Data & Evidence. 2025;5(2):40-57. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-073. EDN: CNBYJS
Введение / Introduction
Устойчивость к противомикробным препаратам представляет собой важную глобальную проблему здравоохранения XXI века: во всём мире в течение последних десятилетий наблюдается значительный рост инфекций с множественной лекарственной устойчивостью [1][2]. С инфекциями, вызванными возбудителями с множественной лекарственной устойчивостью, связаны неблагоприятные клинические (прежде всего повышенные риски летального исхода) и экономические исходы [3–8].
Цефтобипрол, активная форма пролекарства цефтобипрола медокарила — цефалоспорин V поколения [9]. Эффективен в отношении штаммов-продуцентов пенициллинсвязывающих белков (penicillin binding proteins; PBP), включая PBP2a метициллинрезистентного золотистого стафилококка (methicillin-resistant Staphylococcus; MRSA), PBP2x пенициллин-резистентных пневмококков и штаммов с промежуточной чувствительностью к ванкомицину (vancomycin-intermediate Staphylococcus aureus; VISA). Цефтобипрол также эффективен в отношении большинства энтеробактерий за счёт устойчивости к действию хромосомных β-лактамаз типа AmpC [10][11]. В отличие от цефтаролина, цефтобипрол демонстрирует профиль связывания, аналогичный профилю цефепима и цефтазидима с пенициллинсвязывающими белками синегнойной палочки. Эти свойства объясняют расширенный спектр активности цефтобипрола и его показания при нозокомиальной пневмонии, при которой синегнойная палочка является распространённым патогеном [12].
С точки зрения эффективности и безопасности применения в группе пациентов с нозокомиальной пневмонией и сопутствующими факторами такими, как возраст старше 75 лет, хроническая обструктивная болезнь лёгких, бактериемия, цефтобипрол значимо снижал летальность в сравнении с комбинацией цефтазидим и линезолид, в сочетании с меньшими рисками развития псевдомембранозного колита, ассоциированного с C. difficile [13][14].
В РФ цефтобипрол одобрен для лечения внебольничной и нозокомиальной пневмонии у пациентов в возрасте от 18 лет, в США — для лечения взрослых с инфекциями кровотока, вызванными золотистым стафилококком (бактериемия), в том числе с правосторонним инфекционным эндокардитом; взрослых с острыми бактериальными инфекциями кожи и мягких тканей; а также у взрослых и детей в возрасте от трёх месяцев с внебольничной бактериальной пневмонией [15][16].
Цель исследования / Objective
Сравнение эффективности и безопасности цефалоспоринов V поколения цефтаролина фосамила и цефтобипрола при применении у взрослых пациентов в терапии инфекций различной локализации.
Материалы и методы / Materials and methods
Проведён систематический обзор литературы с метаанализом и непрямым сравнением результатов исследований по оценке эффективности и безопасности применения цефтобипрола и цефтаролина у взрослых пациентов в терапии инфекций различных локализаций.
В качестве клинических исходов оценены:
- частота клинического излечения, оцениваемая как исчезновение симптомов инфекции или их улучшение, не требующее продолжения антимикробной терапии;
- частота микробиологической эрадикации, оцениваемая как отсутствие исходного патогена в образце мокроты/гноя, а также все случаи, когда у пациентов больше не было биоматериала для забора в связи с разрешением симптомов заболевания;
- летальность;
- частота развития серьёзных нежелательных явлений (СНЯ);
- частота нежелательных явлений (НЯ), по мнению исследователей, связанных с приёмом исследуемого препарата (ИП);
- частота развития диареи.
Поиск клинических исследований осуществлялся в электронной базе PubMed, а также в регистре клинических исследований clinicaltrials. gov двумя независимыми исследователями по поисковому запросу [ceftaroline] OR [ceftobiprole].
Критерии включения:
- контролируемые исследования по оценке эффективности и безопасности цефтаролина, цефтобипрола;
- результаты исследований содержат сведения о следующих критериях эффективности: частота выздоровления и/или летальность и/или микробиологическая эрадикация;
- результаты исследований содержат сведения о следующих критериях безопасности: частота СНЯ и/или частота НЯ, оцененных исследователем, как связанные с ИП и/или частота развития диареи;
- пациенты 18 лет и старше;
- доступность полнотекстовой версии результатов исследования.
Критерии исключения отсутствовали.
Для проведения метаанализа использовано программное обеспечение Кокрановского сотрудничества Review Manager (RevMan).
При наличии статистически значимой гетерогенности исследований (p <0,10 в тесте Хи-квадрат и I2 >40 %) применяли модель случайных эффектов; при отсутствии статистически значимой гетерогенности (p ≥0,10 в тесте Хи-квадрат и I2 ≤40 %) — модель фиксированного эффекта.
При проведении метаанализа и непрямого сравнения альтернатив производили расчёт точечной величины относительного эффекта — отношения шансов (ОШ) развития события, 95 % доверительного интервала (ДИ) и статистической значимости различий (р), принятой ≤0,01.
При проведении непрямого сравнения расчёт ОШ проводили по формуле:
OШA: C = OШA: B / OШB: C, где
ОШ — отношение шансов;
А и С — сравниваемые стратегии;
В — общий контроль.
Для метаанализа данных, включавшего 5 исследований и более, с помощью построения воронкообразной диаграммы рассеяния проводили оценку публикационного смещения с последующим определением симметричности расположения результатов относительно оси центральной тенденции.
Результаты / Results
Результаты поиска представлены на рис. 1.
Всего в результате поиска получены сведения о 454 публикациях, 442 из них исключены из систематического обзора (рис. 1). Сведения о включённых исследованиях (n=12) приведены в табл. 1.
Таблица 1. Сведения об исследованиях, включённых в метаанализ Table 1. Details of studies included in the meta-analysis | ||||||
Клинические исследования [источник] | Дизайн | Группы (популяция intent-to-treat, ITT) | Клиническое излечение, % | Летальность, % | Микробиологическая эрадикация, % | Безопасность |
Бактериемия | ||||||
ERADICATE Цефтобипрол для лечения осложнённой бактериемии, вызванной золотистым стафилококком (Holland TL, 2023) [17] | РКИ, фаза 3, двойное слепое, не меньшей эффективности | 387 пациентов: 189 в группе цефтобипрола, 198 в группе даптомицин медиана возраста 58 лет м — 69,3 % СД — 34,9 % инфекция кожи и мягких тканей — 61,2 % | 132 из 189 (69,8 %) в группе цефтобипрола и 136 из 198 (68,7 %) в группе контроля ОШ 1,05 95 % ДИ 0,68; 1,62 p=0,8 | 17 из 189 в (9,0 %) в группе цефтобипрола против 18 из 198 (9,1 %) в группе контроля ОШ 1,04 95 % ДИ 0,52; 2,10 p=0,89 | 155 из 189 в (82,0 %) в группе цефтобипрола и 153 из 198 (77,3 %) в группе контроля ОШ 1,04 95 % ДИ 0,61; 1,75 p=0,87 | СНЯ — 36 из 191 пациентов (18,8 %) группа цефтобипрола и 45 из 198 (22,7 %) — даптомицина НЯ, связанные с ИП — 25 из 191 (13,1 %) в группе цефтобипрола и 11 из 198 (5,6 %) в группе контроля Диарея — 8 из 191 (4,2 %) в группе цефтобипрола и 2 из 198 (1,0 %) в контроле |
Внебольничная пневмония (ВП) | ||||||
Цефтобипрол медокарил и цефтриаксон с линезолидом или без него для лечения пациентов с ВП, нуждающихся в госпитализации (Nicholson SC, 2012) [18] | РКИ, фаза 3, двойное слепое | 638 пациентов: 314 цефтобипрол 324 цефтриаксон+/-линезолид (15 % пациентов) Средний возраст 54,5 года, более 1/3 (37 %) ≥65 лет. Женщин 43 % 32 % PORT III 22 % PORT IV–V | 240/314 (76,4 %) в группе цефтобипрола против 257/324 (79,3 %) в группе контроля ОШ 0,84 95 % ДИ 0,58; 1,22 p=0,38 | 1/314 (0,3 %) в группе цефтобипрола против 3/324 (0,9 %) в группе контроля ОШ 0,34 95 % ДИ 0,03; 3,3 p=0,35 | 70/87 (80,5 %) в группе цефтобипрола против 79/97 (81,4 %) в группе контроля ОШ 0,93 95 % ДИ 0,45; 1,96 p=0,86 | Частот СНЯ не указана Частота НЯ, связанные с ИП 36 % из 314 в группе цефтобипрола и 26 % из 324 в контроле Диарея данные не приведены |
Цефтаролин фосамил в сравнении с цефтриаксоном для лечения пациентов из Азии с ВП (Zhong NS, 2015) [19] | РКИ, фаза 3, двойное слепое, не меньшей эффективности | 381 в группе цефтаролина 383 в группе цефтриаксона средний возраст 66,1 (стандартное отклонение 14,7) против 65,8 (13,9) ж/м 30/70 ИМТ — 22 кг/м2 PORT III — 67/69 % PORT IV — 33/31 % | 305 из 381 (80,1 %) в группе цефтаролина и 256 из 382 (67,0 %) в группе цефтриаксона | 3 из 381 (0,8 %) в группе цефтаролина и 4 из 383 (0,8 %) в группе цефтриаксона | Не оценивали | СНЯ: 30 из 381 (7,9 %) в группе цефтаролина против 29 из 383 (7.5 %) в группе контроля Диарея 25 из 381 (6,6 %) в группе цефтаролина и 13 из 383 (3.4 %) в группе контроля Частота НЯ, связанные с ИП данные не представлены |
FOCUS 1 Эффективность и безопасность цефтаролина фосамила в сравнении с цефтриаксоном при ВП (File TM Jr, 2011) [20] | РКИ, фаза 3, двойное слепое, многоцентровое | 291 человек группа цефтаролина фосамила, 300 — цефтриаксона средний возраст — 61 год+/–16,6 мужчин 64 % PORT III — 65,3 %/60,7 % PORT IV — 34,7 %/39,3 % | 83,8 % (244 из 291) в группе цефтаролина фосамила и 77,7 % (233 из 300) — цефтриаксона | 6 из 291 (2,1 %) в группе цефтаролина, 6 из 300 (2 %) в группе контроля | 88,0 % (66 из 75) в группе цефтаролина и 78.8 % (63 из 80) в группе цефтриаксона | СНЯ — 28 из 298 (9,4 %) в группе цефтаролина и 33 из 308 (10,7 %) в группе контроля Частота НЯ, связанные с приёмом ИП данные не представлены Диарея 14 из 298 (4,7 %) в группе цефтаролина и 7 из 308 (2,3 %) в контроле |
Клинические исследования [источник] | Дизайн | Группы (популяция intent-to-treat, ITT) | Клиническое излечение, % | Летальность, % | Микробиологическая эрадикация, % | Безопасность |
Внебольничная пневмония (ВП) | ||||||
FOCUS 2 Эффективность и безопасность цефтаролина фосамила в сравнении с цефтриаксоном при ВП (Low DE, 2011) [21] | РКИ, фаза 3, двойное слепое, многоцентровое | Цефтаролин фосамил=289 Цефтриаксон=273 средний возраст пациентов 60,6+16,1 м — 60 % PORT III — 58,8 %/62,6 % PORT IV — 41,2 %/37,4 % | 81,3 % (235 из 289) для цефтаролина фосамила и 75.5 % (206 из 273) для цефтриаксона | Не указано | 82,2 % (74 из 90) в группе цефтаролина и 81.8 % (72 из 88) в группе цефтриаксона | СНЯ — 41 из 315 (13,0 %) в группе цефтаролина и 39 из 307 (12,7 %) в группе контроля Частота НЯ, связанные с приёмом ИП данные не представлены Диарея — 12 из 315 (3,8 %) в группе цефтаролина, 9 из 307 (2,9 %) в контроле |
Нозокомиальная пневмония | ||||||
Цефтобипрол медокарил в сравнении с цефтазидимом и линезолидом для лечения ВП (Awad SS, 2014) [22] | РКИ, фаза 3, двойное слепое, многоцентровое | 781 пациент: 391 цефтобипрол, 390 цефтазидим/линезолид м — 71 % против 62 % пациентов в группах цефтобипрола и сравнения соответственно, 45 % против 47 % пациентов в возрасте старше 65 лет в группах цефтобипрола и сравнения соответственно. СД 20 % — в обеих группах | 195 из 391 (49,9 %) в группе цефтобипрола против 206 из 390 (52,8 %) ОШ 0,88 95 % ДИ 0,67; 1,17 p=0,4 | 65 из 391 (16,7 %) для цефтобипрола и 70 из 390 (18,0 %) для цефтазидима/линезолида ОШ 0,91 95 % ДИ 0,62; 1,32 p=0,62 | 105 из 269 (39,0 %) в группе цефтобипрола и 127 из 267 (47,6 %) в контроле ОШ 0,7 95 % ДИ 0,5;0,99 p=0,04 | СНЯ данные не представлены НЯ, связанные с приёмом ИП — 96 из 386 (24,9 %) в группе цефтобипрола и 98 из 386 (25,4 %) в контроле Диарея — 12 из 386 (3,1 %) в группе цефтобипрола и 25 из 386 (6,5 %) в группе контроля |
Инфекции кожи и мягких тканей (ИКМТ) | ||||||
TARGET Сравнение цефтобипрола с ванкомицином и азтреонамом при лечении острых бактериальных ИКМТ (Overcash JS, 2021) [23] | РКИ, фаза 3, двойное слепое, многоцентровое | 679 пациентов: цефтобипрол (n=335) или ванкомицин/азтреонам (n=344). медиана возраста — 50 лет мужчин 59 % СД — 11 % оперировано –14 % некрэктомия — 7 % | 302 из 335 (90,1 %) в группе цефтобипрола и 306 из 344 (89,0 %) в группе контроля | 1 из 335 в группе (0,3 %) цефтобипрола, 4 из 344 (1,2 %) — в группе ванкомицин / азтреонам ОШ 0,25 95 % ДИ 0,02; 2,2 p=0,22 | 97,8 % из 203 в группе цефтобипрола против 87,7 % из 223 в группе ванкомицина/азтреонама | СНЯ 6 из 334 (1,8 %) в группе цефтобипрола против 12 из 342 (3,5 %) случаев в группе ванкомицина/азтреонама Связанные с приёмом ИП — 66 из 334 (19,8 %) в группе цефтобипрола и 62 из 342 (18,1 %) в группе контроля Диарея — 21 из 334 (6,3 %) в группе цефтобипрола и 16 из 342 (4,7 %) в группе контроля |
Цефтобипрол в лечении оИКМТ, вызванных грамположительными бактериями (Noel GJ, 2008) [24] | РКИ, фаза 3, двойное слепое, не меньшей эффективности | 312 получали цефтобипрол и 301 — ванкомицин средний возраст 48,0 (стандартное отклонение 16,1) в группе цефтобипрола и 46,7 (16,3) в контроле мужчин 55 % в группе цефтобипрола, 61 % — в контроле | 252 из 312 (80,8 %) пациентов, получавших цефтобипрол, и 236 из 301 (78,4 %) пациентов, получавших ванкомицин | Данные не представлены | Данные не представлены | СНЯ — 24 из 389 (6,2 %) в группе цефтобипрола против 23 из 382 (6.0 %) в контроле. Связанные с лечением данные не представлены Диарея — 21 из 389 (5,4 %) в группе цефтобипрола и 15 из 382 (3,9 %) в группе контроля |
Цефтобипрол медокарил с ванкомицином и цефтазидимом для лечения пациентов с оИКМТ (Noel GJ, 2008) [25] | РКИ, фаза 3, двойное слепое | цефтобипрол (n=547) ванкомицин плюс цефтазидим (n=281) средний возраст 52,9+/- 15,5 мужчин — 63 % СДС 31 % хирургическое вмешательство — 40 % | 81,9 % (448 из 547) в группе цефтобипрола и 80,8 % (227 из 281) в группе ванкомицин плюс цефтазидим | Данные не представлены | 88 % (344 из 391) в группе цефтобипрола и 89 % (177 из 199) в группе ванкомицин плюс цефтазидим | СНЯ 39 из 543 (7,2 %) в группе цефтобипрола и 24 из 279 (8.6 %) в группе ванкомицин плюс цефтазидим Связанные с ИП данные не представлены диарея — 41 из 543 (7,6 %) в группе цефтобипрола и 17 из 279 (6,1 %) в группе контроля |
CANVAS 1 Цефтаролина фосамил в лечении оИКМТ (Corey GR, 2010) [26] | РКИ, фаза 3, двойное слепое | 698 пациентов: 351 группа цефтаролина, 347 — ванкомицин в сочетании с азтреонамом средний возраст 47,2+/–17,0 м — 62,7 % вскрытие, дренирование очага инфекции 6 % некрэктомия 5 % СД — 18 % | 304 из 351 (86,6 %) в группе цефтаролина против 297 из 347 (85,6 %) в контроле | 3 из 351 (0,9 %) в группе цефтаролина и 0 из 347 (0 %) в группе контроля | 86,3 % из 244 в группе цефтаролина; 83,7 % из 227 в группе ванкомицина и азтреонама | СНЯ — 16 из 351 (4,6 %) в группе цефтаролина и 12 из 347 (3,5 %) в группе контроля НЯ, связанные с ИП — 99 из 351 (28,2 %) в группе цефтаролина и 99 из 347 (28,5 %) в группе контроля Диарея — 12 из 351 (3,4 %) в группе цефтаролина 11 из 347 (3,1 %) в группе контроля |
CANVAS 2 Цефтаролина фосамил в лечении оИКМТ (Wilcox MH, 2010) [27] | РКИ, фаза 3, двойное слепое | Цефтаролин фосамил (n=342) ванкомицин плюс азтреонам (n=338) средний возраст 47,8+17,0 м — 65,5 % вскрытие, дренирование очага инфекции 7 % некрэктомия 3,5 % СД — 17,5 % | 291 из 342 (85,1 %) в группе цефтаролина против 289 из 338 (85,5 %) в контрольной группе | 0 в обеих группах | 86,6 % из 209 цефтаролин 88,4 % из 206 контроль | СНЯ — 14 из 341 (4,1 %) в группе цефтаролина и 16 из 339 (4,7 %) в группе контроля НЯ, связанные с приёмом ИП — 64 из 341 (18,8 %) в группе цефтаролина и 82 из 339 (25,9 %) в группе контроля Диарея — 22 из 341 (6,5 %) в группе цефтаролина и 15 из 339 (4,4 %) в группе контроля |
COVERS Цефтаролин фосамил в дозе 600 мг каждые 8 ч в сочетании с ванкомицином и азтреонамом у пациентов с оИКМТ с системной воспалительной реакцией или сопутствующими заболеваниями (Dryden M, 2016) [28] | РКИ, фаза 3, двойное слепое, не меньшей эффективности | Группа цефтаролина (n=506) Группа азтреонам и ванкомицин (n=255) средний возраст 52,6 (165) м — 61 % СД — 16,6 % | 396 из 506 (78,3 %) в группе цефтаролина и 202 из 255 (79,2 %) | Данные не представлены | Данные не представлены | СНЯ — Данные не представлены НЯ, связанные с ИП 81 из 506 (16,0 %) в группе цефтаролина и 42 из 255 (16,5 %) в группе контроля Диарея — 15 из 506 (3,0 %) в группе цефтаролина и 5 из 255 (2,0 %) в группе контроля |
Примечания: ИМТ — индекс массы тела; ИП — исследуемый препарат; КИ — клиническое исследование; НЯ — нежелательное явление; СД — сахарный диабет; СДС — синдром диабетической стопы; СНЯ — серьёзное нежелательное явление; PORT (Pneumonia Outcomes Research Team) — шкала оценки тяжести пневмонии; ВП — внутрибольничная пневмония; оИКМТ — осложнёнными инфекциями кожи и мягких тканей. Notes: BMI — body mass index; SD — study drug; CT — clinical trial; AE — adverse event; DM — diabetes mellitus; DFS — diabetic foot syndrome; SAE — serious adverse event; PORT (Pneumonia Outcomes Research Team) — pneumonia severity assessment scale; HAP — hospital-acquired pneumonia; cSSTI — complicated skin and soft tissue infections. | ||||||
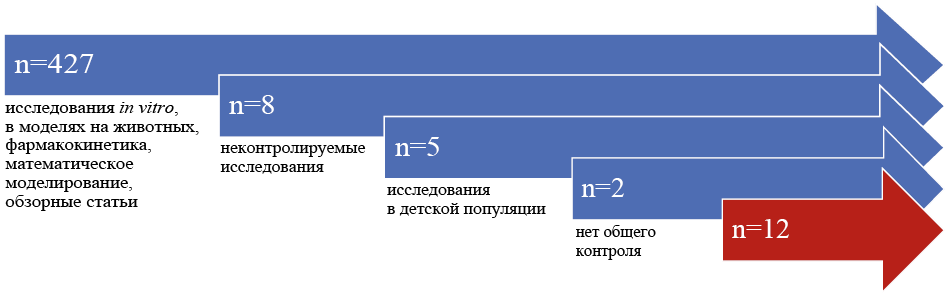
Рис. 1. Результаты поиска
Fig. 1. Search results
Не включены следующие исследования:
Применение у лиц младше 18 лет: Bosheva M. с соавт., 2021 [29], Blumer J. L. с соавт., 2016 [30], Korczowski B. с соавт., 2016 [31], Bradley J. S. с соавт., 2020 [32], Cannavino C. R. с соавт., 2016 [33].
Отсутствие контроля: Gentile I. с соавт., 2023 [34], Zhanel G. G. с соавт., 2021 [35], Mahmoud E. с соавт., 2020 [36], Giuliano S. с соавт., 2023 [37], Hidalgo-Tenorio C. с соавт., 2023 [38], Zampino R. с соавт., 2023 [39], Bellut H. с соавт., 2024 [40], Membrillo de Novales F. J., 2025 [41], Pham T. T. с соавт., 2021 [42], Caniff K. E. с соавт., 2024 [43], Villa S. с соавт. 2025 [44].
Нет общего контроля: Geriak M. с соавт., 2019 (рассматриваемая стратегия — комбинация цефтаролина и даптомицина) [45], Talbot G. H. с соавт., 2007 (в качестве терапии в группе сравнения применяли терапию ванкомицином, что не в полной мере сопоставимо с двойной комбинацией, включающей бета-лактам) [46].
Сведения о качестве включённых в метаанализ исследований приведены в табл. 2.
Таблица 2. Оценка качества включённых исследований Table 2. Quality assessment of included studies | |||||||
Исследования | Ошибка, связанная с методом генерации рандомизационной последовательности | Ошибка, связанная с отсутствием сокрытия рандомизационной последовательности | Ошибка, связанная с ослеплением пациентов и персонала | Ошибка, связанная с ослеплением лиц, оценивающих вмешательство | Ошибка, связанная с пропуском данных | Ошибка, связанная с представлением результатов | Другие возможные ошибки |
ERADICATE | + | + | + | + | + | + | ? |
Nicholson SC, 2012 | + | ? | + | + | + | + | ? |
Zhong NS, 2015 | + | + | + | + | + | + | ? |
FOCUS 1 | + | - | + | + | + | + | ? |
FOCUS 2 | + | - | + | + | + | + | ? |
Awad SS, 2014 | + | - | + | + | + | + | ? |
TARGET | + | + | + | + | + | + | ? |
Noel GJ, Strauss RS, 2008 | + | + | + | ? | + | + | ? |
Noel GJ, Bush K., 2008 | + | + | + | + | + | + | ? |
CANVAS 1 | + | + | + | + | + | ? | ? |
CANVAS 2 | + | + | + | + | + | ? | ? |
COVERS | + | + | + | + | + | + | ? |
Исходя из данных, приведённых в табл. 2, видно, что все включённые в исследование РКИ, за исключением РКИ Noel G. J., Strauss R. S. с соавт., 2008, имеют низкий уровень систематических ошибок, что соответствует уровню доказательности IIA. РКИ Noel G. J., Strauss R. S. с соавт. имеет средний риск систематической ошибки, что соответствует удовлетворительному методологическому качеству и уровню доказательности IIB.
Исследования эффективности и безопасности цефтобипрола при бактериемии и нозокомиальной пневмонии ввиду отсутствия подобных исследований по эффективности цефтаролина при применении в указанных группах пациентов учтены только при проведении метаанализа данных о безопасности их применения.
Исследования эффективности цефтаролина и цефтобипрола в лечении внебольничной пневмонии были не в полной мере сопоставимы по характеристикам, включённым в них пациентов. Так, РКИ Zhong N. S. с соавт. (2015) проведено в азиатской популяции пациентов, что в тоже время маловероятно влияет на эффективность проводимой терапии. РКИ Nicholson S. C. с соавт. (2012) включало пациентов с более лёгким течением заболевания, оцененного по шкале PORT, по сравнению с РКИ цефтаролина, тем не менее, ввиду того, что по другим характеристикам пациенты были сопоставимы, данное исследование с ограничениями было включено в непрямое сравнение. РКИ по оценке эффективности и безопасности цефтаролина и цефтобипрола при осложнённых инфекциях кожи и мягких тканей (оИКМТ) были сопоставимы по основным клинико-демографическим характеристикам включённых в них пациентов.
Ввиду отсутствия исследований, напрямую сравнивающих альтернативы (цефтаролин и цефтобипрол), проведено контролируемое непрямое сравнение альтернатив через общее лекарственное средство/комбинацию лекарственных средств сравнения, которым для пациентов с внебольничной пневмонией являлся цефтриаксон, для инфекций кожи и мягких тканей — ванкомицин + бета-лактам (азтреонам или цефтазидим). В РКИ Nicholson SC с соавт. (2012) 15 % пациентов с внебольничной пневмонией получали комбинированную терапию цефтриаксон + линезолид. С учётом малого количества пациентов, получивших двойную терапию, исследование включено в сеть непрямого сравнения как имеющее общий с другими исследованиями контроль. В РКИ Noel G. J., Strauss R. S. с соавт. (2008) эффективность цефтобипрола в лечении оИКМТ оценивали в сравнении с монотерапией ванкомицином, что не сопоставимо по эффективности с терапией комбинацией бета-лактам + ванкомицин, применяемой в других исследованиях. Ввиду чего указанное исследование не включили в метаанализ данных по оценке эффективности, но учитывали при проведении метаанализа сведений о безопасности терапии.
Схема непрямого сравнения приведена на рис. 2.
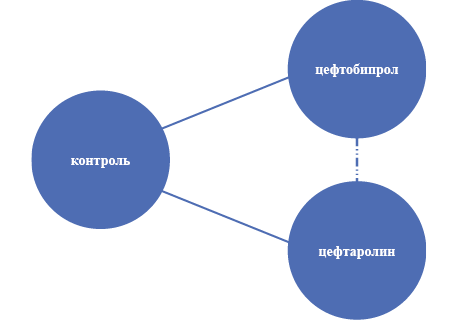
Рис. 2. Схема непрямого сравнения
Fig. 2. Indirect comparison scheme
Внебольничная пневмония / Community-acquired pneumonia
Эффективность цефтобипрола в лечении внебольничной пневмонии оценена в единственном из включенных РКИ (Nicholson S. C. с соавт., 2012), которое продемонстрировало, что в сравнении с терапией цефтриаксон с линезолидом или без него, цефтобипрол обладал сравнимой эффективностью как в отношении клинического излечения (ОШ 0,84, 95 % ДИ 0,58; 1,22, p=0,38), так и в отношении летальности (ОШ 0,34, 95 % ДИ 0,03; 3,3, p=0,35) и микробиологической эрадикации (ОШ 0,93, 95 % ДИ 0,45; 1,96, p=0,86) [15].
Результаты метаанализа РКИ эффективности цефтаролина в лечении внебольничной пневмонии в отношении достижения клинической излеченности приведены на рис. 3.
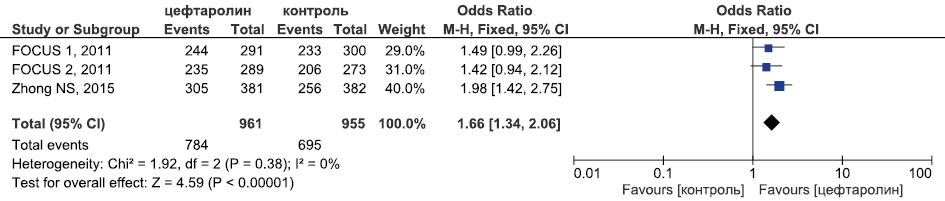
Рис. 3. Метаанализ РКИ эффективности цефтаролина в лечении внебольничной пневмонии в отношении достижения клинической излеченности
Fig. 3. Meta-analysis of RCTs of the efficacy of ceftaroline in the treatment of community-acquired pneumonia in terms of achieving clinical cure
Результаты метаанализа РКИ по оценке эффективности цефтаролина в лечении внебольничной пневмонии в отношении летальности приведены на рис. 4.
Результаты метаанализа РКИ эффективности цефтаролина в лечении внебольничной пневмонии в отношении достижения микробиологической эрадикации приведены на рис. 5.
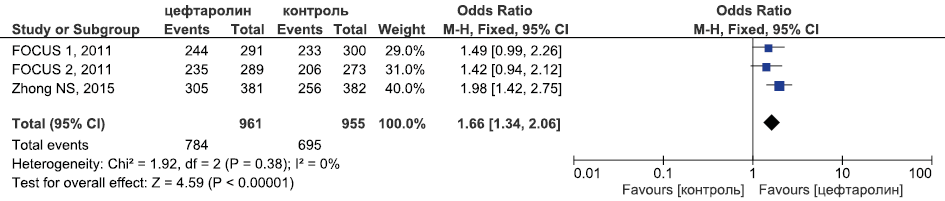
Рис. 4. Метаанализ РКИ эффективности цефтаролина в лечении внебольничной пневмонии в отношении летальности
Fig. 4. Meta-analysis of RCTs of the efficacy of ceftaroline in the treatment of community-acquired pneumonia in terms of mortality
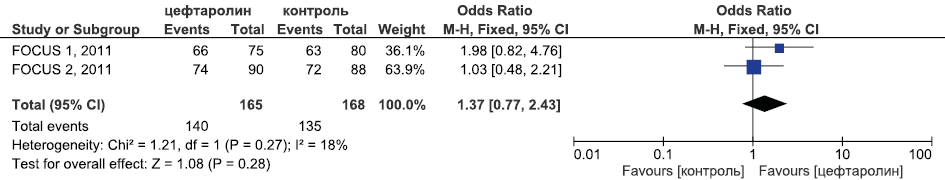
Рис. 5. Метаанализ РКИ эффективности цефтаролина в лечении внебольничной пневмонии в отношении достижения микробиологической эрадикации
Fig. 5. Meta-analysis of RCTs of the efficacy of ceftaroline in the treatment of community-acquired pneumonia in achieving microbiological eradication
Исходя из данных, представленных на рис. 3–5, видно, что цефтаролин был статистически достоверно эффективнее цефтриаксона в отношении частоты достижения клинической излеченности (ОШ 1,66, 95 % ДИ 1,34; 2,06, p <0,0001), сопоставим с эффективностью цефтриаксона в отношении летальности (ОШ 0,92, 95 % ДИ 0,37; 2,28, p=0,92) и частоты микробиологической эрадикации (ОШ 1,37, 95 % ДИ 0,77; 2,43, p=0,28).
Результаты непрямого сравнения эффективности цефтаролина и цефтобипрола в лечении пациентов с внебольничной пневмонией приведены в табл. 3.
Таблица 3. Результаты непрямого сравнения эффективности цефтаролина и цефтобипрола в лечении пациентов с внебольничной пневмонией Table 3. Results of an indirect comparison of the efficacy of ceftaroline and ceftobiprole in the treatment of patients with community-acquired pneumonia | |||
Исход | Цефтобипрол | Цефтаролин | Результаты непрямого сравнения |
Клиническое излечение | 240/314 ОШ 0,84 95 % ДИ 0,58; 1,22 p=0,38 | 784/961 ОШ 1,66 95 % ДИ 1,34; 2,06 p <0,0001 | ОШ 0,73 95 % ДИ 0,53; 0,99 p=0,047 |
Летальность | 1/314 ОШ 0,34 95 % ДИ 0,03; 3,3 p=0,35 | 9/672 ОШ 0,92 95 % ДИ 0,37; 2,28 p=0,92 | ОШ 0,23 95 % ДИ 0,03; 1,86 p=0,17 |
Микробиологическая эрадикация | 70/87 ОШ 0,93 95 % ДИ 0,45; 1,96 p=0,86 | 140/165 ОШ 1,37 95 % ДИ 0,77; 2,43 p=0,28 | ОШ 0,73 95 % ДИ 0,37; 1,45 p=0,37 |
Примечания: ОШ — отношение шансов; ДИ — доверительный интервал; p — уровень статистической значимости. Notes: OR — odds ratio; CI — confidence interval; p — level of statistical significance. | |||
Непрямое контролируемое сравнение альтернатив продемонстрировало, что цефтобипрол и цефтаролин сопоставимы по эффективности в отношении достижения клинической излеченности (ОШ 0,73, 95 % ДИ 0,53; 0,99, p=0,047), летальности (ОШ 0,23, 95 % ДИ 0,03; 1,86, p=0,17) и микробиологической эрадикации (ОШ 0,73, 95 % ДИ 0,37; 1,45, p=0,37) в лечении пациентов с внебольничной пневмонией.
Инфекция кожи и мягких тканей / Skin and soft tissue infection
Результаты метаанализа РКИ эффективности цефтобипрола в лечении оИКМТ в отношении клинической излеченности приведены на рис. 6.
Результаты метаанализа РКИ эффективности цефтобипрола в лечении оИКМТ в отношении микробиологической эрадикации приведены на рис. 7.
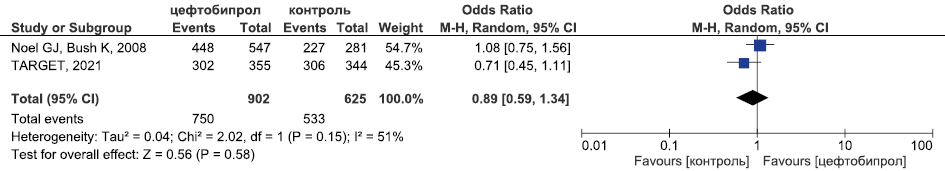
Рис. 6. Метаанализ РКИ эффективности цефтобипрола в лечении оИКМТ в отношении клинической излеченности
Fig. 6. Meta-analysis of RCTs of the efficacy of ceftobiprole in the treatment of cSSTIs in terms of clinical cure
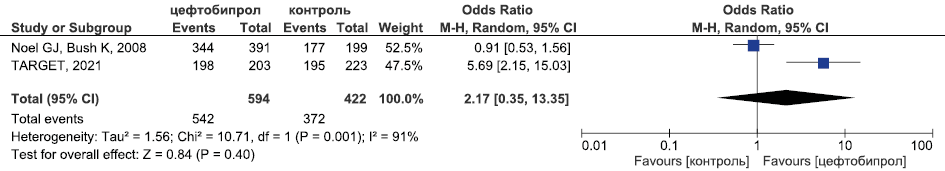
Рис. 7. Метаанализ РКИ эффективности цефтобипрола в лечении оИКМТ в отношении микробиологической эрадикации
Fig. 7. Meta-analysis of RCTs of the efficacy of ceftobiprole in the treatment of cSSTIs in terms of microbiological eradication
Исходя из данных, представленных на рис. 6 и 7 цефтобипрол был сопоставим по эффективности с комбинацией ванкомицин + бета-лактам в отношении клинической излеченности (ОШ 0,89, 95 % ДИ 0,59; 1,34, p=0,58) и микробиологической эрадикации (ОШ 2,17, 95 % ДИ 0,35; 13,35, p=0,4). Эффективность цефтобипрола в отношении летальности у пациентов с оИКМТ оценена в единственном исследовании TARGET: было продемонстрировано, что альтернативы были равноэффективны в отношении указанного показателя (ОШ 0,25, 95 % ДИ 0,02; 2,2, p=0,22) [20].
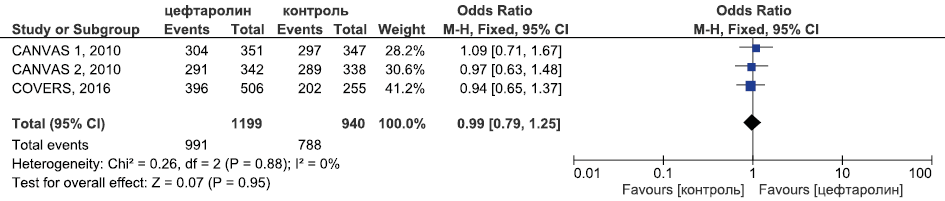
Рис. 8. Метаанализ РКИ эффективности цефтаролина в лечении оИКМТ в отношении клинической излеченности
Fig. 8. Meta-analysis of RCTs of the efficacy of ceftaroline in the treatment of cSSTI in terms of clinical cure
Результаты метаанализа РКИ эффективности цефтаролина в лечении оИКМТ в отношении клинической излеченности приведены на рис. 8.
Результаты метаанализа РКИ эффективности цефтаролина в лечении оИКМТ в отношении летальности приведены на рис. 9.
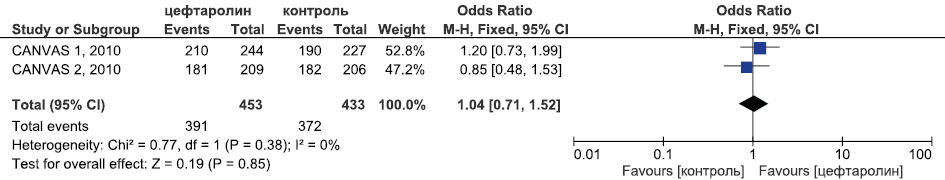
Рис. 9. Метаанализ РКИ эффективности цефтаролина в лечении оИКМТ в отношении летальности
Fig. 9. Meta-analysis of RCTs of the efficacy of ceftaroline in the treatment of cSSTI in terms of mortality
Результаты метаанализа РКИ эффективности цефтаролина в лечении оИКМТ в отношении микробиологической эрадикации приведены на рис. 10.
Метаанализ продемонстрировал равную эффективность цефтаролина и комбинации ванкомицина и бета-лактама в терапии ИКМТ как в отношении клинической излеченности (ОШ 0,99, 95 % ДИ 0,79; 1,25, p=0,95) и летальности (ОШ 6,98, 95 % ДИ 0,36; 135,63, p=0,2), так и микробиологической эрадикации (ОШ 1,04, 95 % ДИ 0,71; 1,52, p=0,85) (рис. 8–10).
Результаты непрямого сравнения эффективности цефтаролина и цефтобипрола в лечении пациентов с оИКМТ приведены в табл. 4.

Рис. 10. Метаанализ РКИ эффективности цефтаролина в лечении оИКМТ в отношении микробиологической эрадикации
Fig. 10. Meta-analysis of RCTs of the efficacy of ceftaroline in the treatment of cSSTI in terms of microbiological eradication
Таблица 4. Результаты непрямого сравнения эффективности цефтаролина и цефтобипрола в лечении пациентов с оИКМТ Table 4. Results of an indirect comparison of the efficacy of ceftaroline and ceftobiprole in the treatment of patients with cSSTI | |||
Исход | Цефтобипрол | Цефтаролин | Результаты непрямого сравнения |
Клиническое излечение | 750 из 902 ОШ 0,89 95 % ДИ 0,59; 1,34 p=0,58 | 991 из 1199 ОШ 0,99 95 % ДИ 0,79; 1,25 p=0,95 | ОШ 1,035 95 % ДИ 0,82; 1,3 p=0,76 |
Летальность | 1 из 335 ОШ 0,25 95 % ДИ 0,02; 2,2 p=0,22 | 3 из 693 ОШ 6,98 95 % ДИ 0,36; 135,63 p=0,2 | ОШ 0,68 95 % ДИ 0,07; 6,64 p=0,74 |
Микробиологическая эрадикация | 542 из 594 ОШ 2,17 95 % ДИ 0,35; 13,35 p=0,4 | 391 из 453 ОШ 1,04 95 % ДИ 0,71; 1,52 p=0,85 | ОШ 1,65 95 % ДИ 1,11; 2,44 p=0,01 |
Примечания: ОШ — отношение шансов; ДИ — доверительный интервал; p — уровень статистической значимости. Notes: OR — odds ratio; CI — confidence interval; p — level of statistical significance. | |||
Непрямое контролируемое сравнение альтернатив (табл. 4) продемонстрировало, что цефтаролин и цефтобипрол были сопоставимы по эффективности в отношении частоты клинического излечения (ОШ 1,035, 95 % ДИ 0,82; 1,3, Р=0,76) и летальности (ОШ 0,68, 95 % ДИ 0,07; 6,64, Р=0,74) в лечении пациентов с осложненными ИКМТ. В тоже время цефтобипрол был статистически значимо эффективнее в данной группе пациентов в отношении достижения микробиологической эрадикации (ОШ 1,65, 95 % ДИ 1,11; 2,44, Р=0,01).
Безопасность / Safety
Результаты метаанализа РКИ безопасности цефтобипрола в отношении частоты СНЯ приведены на рис. 11.
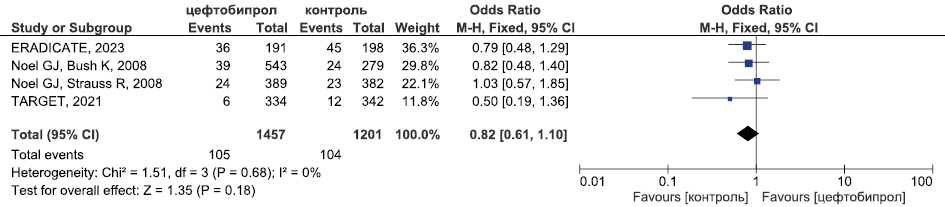
Рис. 11. Метаанализ РКИ безопасности цефтобипрола в отношении частоты СНЯ
Fig. 11. Meta-analysis of RCTs of ceftobiprole safety in terms of SAE incidence
Результаты метаанализа РКИ безопасности цефтобипрола в отношении частоты НЯ, связанных с ИП, приведены на рис. 12.
Результаты метаанализа РКИ безопасности цефтобипрола в отношении случаев развития диареи приведены на рис. 13.
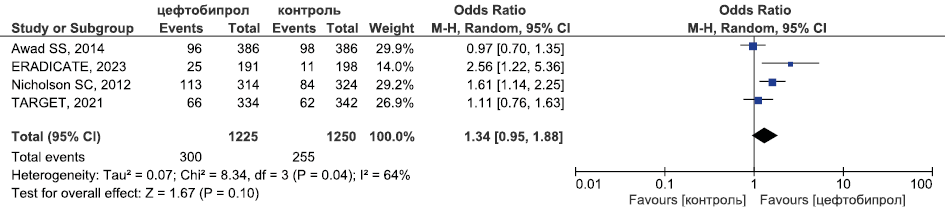
Рис. 12. Метаанализ РКИ безопасности цефтобипрола в отношении частоты НЯ, связанных с исследуемым препаратом
Fig. 12. Meta-analysis of RCTs of ceftobiprole safety in terms of the incidence of AEs associated with the study drug
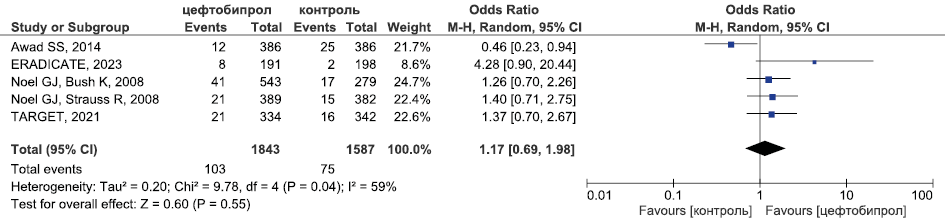
Рис. 13. Метаанализ РКИ безопасности цефтобипрола в отношении случаев развития диареи
Fig. 13. Meta-analysis of RCTs of ceftobiprole safety in terms of diarrhea events
Метаанализ данных о безопасности цефтобипрола (рис. 11–13) продемонстрировал, что его безопасность была сопоставима с безопасностью терапии сравнения (цефтриаксон при лечении внебольничной пневмонии, комбинации бета-лактама и ванкомицина в лечении оИКМТ) в отношении частоты СНЯ (ОШ 0,82, 95 % ДИ 0,61; 1,1, Р=0,18), НЯ, связанных с применением ИП (ОШ 1,34, 95 % ДИ 0,95; 1,88, Р=0,1) и частоты развития диареи (ОШ 1,17, 95 % ДИ 0,69; 1,98, Р=0,55)
Результаты метаанализа РКИ безопасности цефтаролина в отношении частоты СНЯ приведены на рис. 14.
Результаты метаанализа РКИ безопасности цефтаролина в отношении частоты НЯ, связанных с ИП, приведены на рис. 15.
Результаты метаанализа РКИ безопасности цефтаролина в отношении случаев развития диареи приведены на рис. 16.
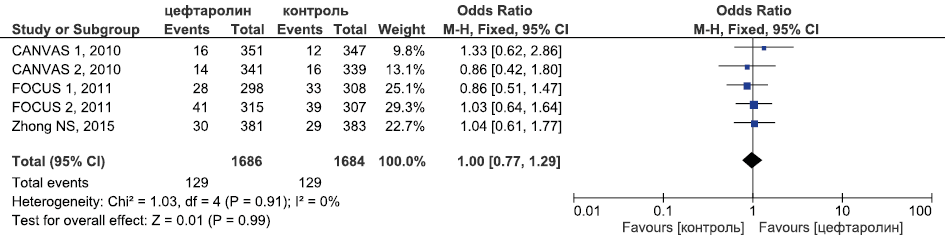
Рис. 14. Метаанализ РКИ безопасности цефтаролина в отношении частоты СНЯ
Fig. 14. Meta-analysis of RCTs of ceftaroline safety in terms of SAE incidence
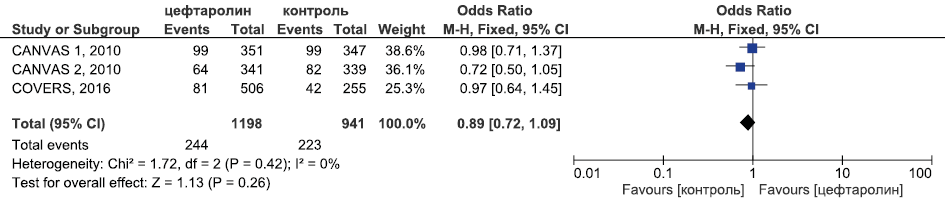
Рис. 15. Метаанализ РКИ безопасности цефтаролина в отношении частоты НЯ, связанных с исследуемым препаратом
Fig. 15. Meta-analysis of RCTs of ceftaroline safety in terms of the incidence of AEs associated with the study drug
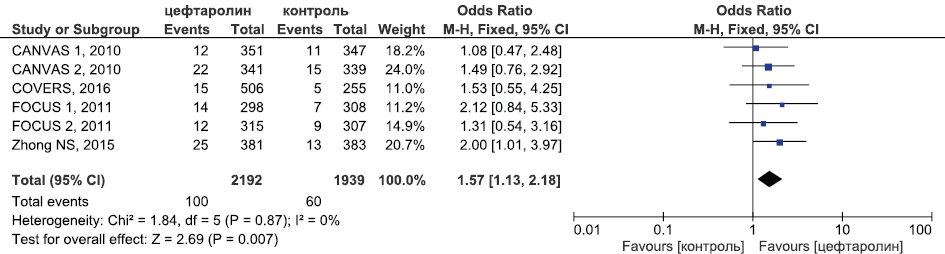
Рис. 16. Метаанализ РКИ безопасности цефтаролина в отношении случаев развития диареи
Fig. 16. Meta-analysis of RCTs of ceftaroline safety in terms of incidence of diarrhea
Метаанализ данных о безопасности цефтаролина (рис. 14–16) продемонстрировал, что цефтаролин был сопоставим в безопасности с цефтриаксоном в лечении внебольничной пневмонии, комбинацией бета-лактама и ванкомицина в лечении оИКМТ в отношении частоты развития СНЯ (ОШ 1,00, 95 % ДИ 0,77; 1,29, p=0,99) и НЯ, связанных с приёмом ИП (ОШ 0,89, 95 % ДИ 0,72; 1,09, p=0,26). Частота диареи была статистически значимо выше в группе цефтаролина в сравнении с контрольной группой (ОШ 1,57, 95 % ДИ 1,13; 2,18, p=0,007).
Результаты непрямого сравнения безопасности цефтаролина и цефтобипрола в лечении пациентов с пневмонией и оИКМТ приведены в табл. 5.
Непрямое сравнение цефтобипрола и цефтаролина в отношении критериев безопасности (табл. 5) продемонстрировало, что они были сопоставимы по частоте случаев развития СНЯ (ОШ 0,93, 95 % ДИ 0,71; 1,22, p=0,63) и диареи (ОШ 1,23, 95 % ДИ 0,93; 1,64, p=0,13).
Оценка риска публикационного смещения приведена на рис. 17–19.
Рис. 18 и 19 свидетельствуют об отсутствии публикационного смещения. Рис. 17 иллюстрирует наличие публикационного смещения, т. е. публикации только результатов, демонстрирующих преимущества исследуемой медицинской технологии в сравнении с альтернативой, что затрудняет интерпретацию результатов непрямого сравнения результатов РКИ в отношении частоты развития диареи.
Таблица 5. Результаты непрямого сравнения безопасности цефтаролина и цефтобипрола в лечении пациентов с пневмонией и оИКМТ Table 5. Results of an indirect comparison of the safety of ceftaroline and ceftobiprole in the treatment of patients with pneumonia and cSSTI | |||
Исход | Цефтобипрол | Цефтаролин | Результаты непрямого сравнения |
Частота СНЯ | 105 из 1457 ОШ 0,82 95 % ДИ 0,61; 1,1 p=0,18 | 129 из 1686 ОШ 1,00 95 % ДИ 0,77; 1,29 p=0,99 | ОШ 0,93 95 % ДИ 0,71; 1,22 p=0,63 |
Частота НЯ, связанных с приёмом ИП | 300 из 1225 ОШ 1,34 95 % ДИ 0,95; 1,88 p=0,1 | 244 из 1198 ОШ 0,89 95 % ДИ 0,72; 1,09 p=0,26 | ОШ 1,26 95 % ДИ 1,04; 1,53 p=0,01 |
Частота развития диареи | 103 из 1843 ОШ 1,17 95 % ДИ 0,69; 1,98 p=0,55 | 100 из 2192 ОШ 1,57 95 % ДИ 1,13; 2,18 p=0,007 | ОШ 1,23 95 % ДИ 0,93; 1,64 p=0,13 |
Примечания: ОШ — отношение шансов; ДИ — доверительный интервал; p — уровень статистической значимости. Notes: OR — odds ratio; CI — confidence interval; p — level of statistical significance. | |||
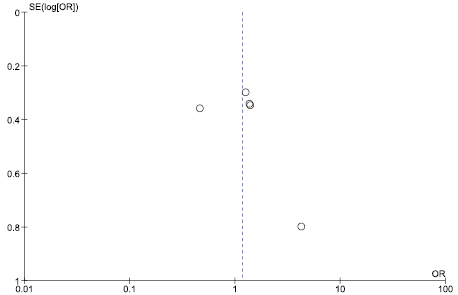
Рис. 17. Оценка риска публикационного смещения в отношении частоты случаев развития диареи на фоне терапии цефтобипролом
Fig. 17. Assessment of the risk of publication bias in relation to the incidence of diarrhea during ceftobiprole therapy
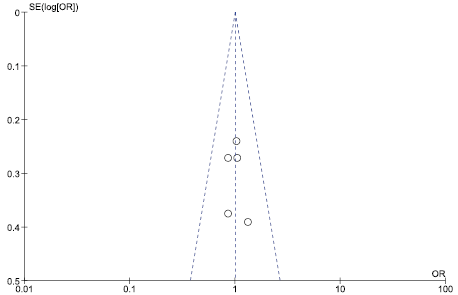
Рис. 18. Оценка рисков публикационного смещения в отношении частоты случаев развития СНЯ на фоне терапии цефтаролином
Fig. 18. Assessment of the risks of publication bias in relation to the incidence of SAEs during ceftaroline therapy
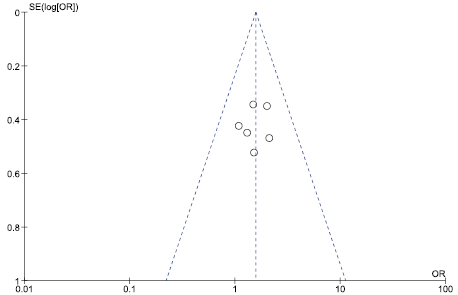
Рис. 19. Оценка рисков публикационного смещения в отношении частоты случаев развития диареи на фоне терапии цефтаролином
Fig. 19. Assessment of the risk of publication bias in relation to the incidence of diarrhea during ceftaroline therapy
Ограничения исследования / Limitations of the study
РКИ Nicholson S. C. с соавт. (2012) включало пациентов с более лёгким течением заболевания, оцененным по шкале PORT, по сравнению с РКИ цефтаролина.
В РКИ Nicholson S. C. с соавт. (2012) 15 % пациентов получало комбинированную терапию цефтриаксон + линезолид.
Существуют риски наличия публикационного смещения в отношении частоты развития диареи на фоне терапии цефтобипролом, что затрудняет интерпретацию результатов непрямого сравнения.
Выводы / Conclusion
В лечении внебольничной пневмонии цефтобипрол был также эффективен в отношении клинического излечения, летальности и микробиологической эрадикации как цефтаролин и комбинация цефтриаксон с линезолидом или без него.
В лечении осложнённых инфекций кожи и мягких тканей цефтобипрол был сопоставим с цефтаролином и комбинацией бета-лактам + ванкомицин в отношении клинического излечения и летальности. В отношении частоты достижения микробиологической эрадикации цефтобипрол был сопоставим с комбинацией бета-лактам + ванкомицин и превосходил по данному показателю цефтаролин (ОШ 1,65, 95 % ДИ 1,11; 2,44, p=0,01);
В лечении инфекций нижних дыхательных путей, осложнённых инфекций кожи и мягких тканей, а также бактериемии цефтобипрол был также безопасен в отношении частоты развития серьёзных нежелательных явлений как цефтаролин (ОШ=0,93; 95 % ДИ 0,71;1,22; p=0,63). Вместе с этим следует учитывать информацию о том, что применение цефтобипрола в группе пациентов с нозокомиальной пневмонией и сопутствующими факторами такими, как возраст старше 75 лет, хроническая обструктивная болезнь лёгких, бактериемия, демонстрирует значимо меньший уровень летальности в сравнении с комбинацией цефтазидим и линезолид.
В лечении инфекций нижних дыхательных путей, осложнённых инфекций кожи и мягких тканей, а также бактериемии цефтобипрол был также безопасен в отношении частоты развития диареи как цефтаролин (ОШ 1,23; 95 % ДИ 0,93; 1,64; p=0,13).
Список литературы
1. GBD 2021 Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance 1990-2021: a systematic analysis with forecasts to 2050. Lancet. 2024 Sep 28;404(10459):1199-1226. doi: 10.1016/S0140-6736(24)01867-1.
2. Кузьменков А.Ю., Виноградова А.Г., Трушин И.В., Эйдельштейн М.В., Авраменко А.А., Дехнич А.В., Козлов Р.С. AMRmap – система мониторинга антибиотикорезистентности в России. Клиническая микробиология и антимикробная химиотерапия. 2021;23(2):198-204. DOI: 10.36488/cmac.2021.2.198-204.
3. Namikawa H, et al. Predictors of mortality from extended-spectrum beta-lactamase-producing Enterobacteriaceae bacteremia. Emerg Microbes Infect. 2023 Dec;12(1):2217951. Doi: 10.1080/22221751.2023.2217951.
4. Tillotson GS, Zinner SH. Burden of antimicrobial resistance in an era of decreasing susceptibility. Expert Rev Anti Infect Ther. 2017 Jul;15(7):663-676. Doi: 10.1080/14787210.2017.1337508.
5. Micek ST, Hampton N, Kollef M. Risk Factors and Outcomes for Ineffective Empiric Treatment of Sepsis Caused by Gram-Negative Pathogens: Stratification by Onset of Infection. Antimicrob Agents Chemother. 2017 Dec 21;62(1):e01577-17. doi: 10.1128/AAC.01577-17. Erratum in: Antimicrob Agents Chemother. 2018 Feb 23;62(3): e00007-18. doi: 10.1128/AAC.00007-18.
6. Pulingam T, Parumasivam T, Gazzali AM, et al. Antimicrobial resistance: Prevalence, economic burden, mechanisms of resistance and strategies to overcome. Eur J Pharm Sci. 2022 Mar 1; 170:106103. doi: 10.1016/j.ejps.2021.106103.
7. Keenan K, Silva Corrêa J, Sringernyuang L, et al. The social burden of antimicrobial resistance: what is it, how can we measure it, and why does it matter? JAC Antimicrob Resist. 2025 Mar 10;7(2):dlae208. doi: 10.1093/jacamr/dlae208.
8. Lewnard JA, Charani E, Gleason A, et al. Burden of bacterial antimicrobial resistance in low-income and middle-income countries avertible by existing interventions : an evidence review and modelling analysis. Lancet. 2024 Jun 1;403(10442):2439-2454. doi: 10.1016/S0140-6736(24)00862-6
9. Zhanel GG, Lam A, Schweizer F, et al. Ceftobiprole. Am J Clin Dermatol. 2008; 9:245–254. doi: 10.2165/00128071-200809040-00004
10. Giacobbe DR, De Rosa FG, Del Bono V, Grossi PA, Pea F, Petrosillo N, Rossolini GM, Tascini C, Tumbarello M, Viale P, Bassetti M. Ceftobiprole: drug evaluation and place in therapy. Expert Rev Anti Infect Ther. 2019 Sep;17(9):689-698. doi: 10.1080/14787210.2019.1667229.
11. Zhanel GG, Voth D, Nichol K, Karlowsky JA, Noreddin AM, Hoban DJ. Pharmacodynamic activity of ceftobiprole compared with vancomycin versus methicillin-resistant Staphylococcus aureus (MRSA), vancomycin-intermediate Staphylococcus aureus (VISA) and vancomycin-resistant Staphylococcus aureus (VRSA) using an in vitro model. J Antimicrob Chemother. 2009 Aug;64(2):364-9. doi: 10.1093/jac/dkp176.
12. Morosini MI, Díez-Aguilar M, Cantón R. Mechanisms of action and antimicrobial activity of ceftobiprole. Rev Esp Quimioter. 2019 Sep;32 Suppl 3(Suppl 3):3-10.
13. Welte T, Scheeren T, Capellier G, Saulay M, Engelhardt M. Clinical cure and mortality outcomes with ceftobiprole medocaril versus ceftazidime plus linezolid in high-risk patients with hospital-acquired pneumonia. Interscience Conference of Antimicrobial Agents and Chemotherapy (ICAAC)/International Congress of Chemotherapy and Infection (ICC); 17-21 September 2015; San Diego, CA. Poster K338
14. Torres A, Mouton JW, Pea F. Pharmacokinetics and dosing of ceftobiprole medocaril for the treatment of hospital- and community-acquired pneumonia in different patient populations. Clin Pharmacokinet. 2016;55(12):1507-1520. doi: 10.1007/s40262-016-0418-z.
15. Государственный реестр лекарственных средств. Общая характеристика лекарственного препарата - № (005209)-(РГ-RU) от 17. 04. 2024 / Зевтера. (Электронный ресурс). Доступен: https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=96af7396-3cf3-4c99-80eb-bef8066a2fe2 (дата обращения 25. 05. 2025).
16. FDA Approves New Antibiotic for Three Different Uses. https://www.fda.gov/news-events/press-announcements/fda-approves-new-antibiotic-three-different-uses
17. Holland TL, Cosgrove SE, Doernberg SB, et al; ERADICATE Study Group. Ceftobiprole for Treatment of Complicated Staphylococcus aureus Bacteremia. N Engl J Med. 2023 Oct 12;389(15):1390-1401. doi: 10.1056/NEJMoa2300220.
18. Nicholson SC, Welte T, File TM Jr, et al. A randomised, double-blind trial comparing ceftobiprole medocaril with ceftriaxone with or without linezolid for the treatment of patients with community-acquired pneumonia requiring hospitalisation. Int J Antimicrob Agents. 2012 Mar;39(3):240-6. doi: 10.1016/j.ijantimicag.2011.11.005.
19. Zhong NS, Sun T, Zhuo C, et al. Ceftaroline fosamil versus ceftriaxone for the treatment of Asian patients with community-acquired pneumonia: a randomised, controlled, double-blind, phase 3, non-inferiority with nested superiority trial. Lancet Infect Dis. 2015 Feb;15(2):161-71. doi: 10.1016/S1473-3099(14)71018-7.
20. File TM Jr, Low DE, Eckburg PB, et al.; FOCUS 1 investigators. FOCUS 1: a randomized, double-blinded, multicentre, Phase III trial of the efficacy and safety of ceftaroline fosamil versus ceftriaxone in community-acquired pneumonia. J Antimicrob Chemother. 2011 Apr;66 Suppl 3: iii19-32. doi: 10.1093/jac/dkr096.
21. Low DE, File TM Jr, Eckburg PB, et al.; FOCUS 2 investigators. FOCUS 2: a randomized, double-blinded, multicentre, Phase III trial of the efficacy and safety of ceftaroline fosamil versus ceftriaxone in community-acquired pneumonia. J Antimicrob Chemother. 2011 Apr;66 Suppl 3:iii33-44. doi: 10.1093/jac/dkr097.
22. Awad SS, Rodriguez AH, Chuang YC, et al. A phase 3 randomized double-blind comparison of ceftobiprole medocaril versus ceftazidime plus linezolid for the treatment of hospital-acquired pneumonia. Clin Infect Dis. 2014 Jul 1;59(1):51-61. doi: 10.1093/cid/ciu219.
23. Overcash JS, Kim C, Keech R, et al. Ceftobiprole Compared With Vancomycin Plus Aztreonam in the Treatment of Acute Bacterial Skin and Skin Structure Infections: Results of a Phase 3, Randomized, Double-blind Trial (TARGET). Clin Infect Dis. 2021 Oct 5;73(7):e1507-e1517. doi: 10.1093/cid/ciaa974.
24. Noel GJ, Strauss RS, Amsler K, et al. Results of a double-blind, randomized trial of ceftobiprole treatment of complicated skin and skin structure infections caused by gram-positive bacteria. Antimicrob Agents Chemother. 2008 Jan;52(1):37-44. doi: 10.1128/AAC.00551-07.
25. Noel GJ, Bush K, Bagchi P, Ianus J, Strauss RS. A randomized, double-blind trial comparing ceftobiprole medocaril with vancomycin plus ceftazidime for the treatment of patients with complicated skin and skin-structure infections. Clin Infect Dis. 2008 Mar 1;46(5):647-55. doi: 10.1086/526527.
26. Corey GR, Wilcox MH, Talbot GH, et al; CANVAS 1 investigators. CANVAS 1: the first Phase III, randomized, double-blind study evaluating ceftaroline fosamil for the treatment of patients with complicated skin and skin structure infections. J Antimicrob Chemother. 2010 Nov;65 Suppl 4:iv41-51. doi: 10.1093/jac/dkq254.
27. Wilcox MH, Corey GR, Talbot GH, et al.; CANVAS 2 investigators. CANVAS 2: the second Phase III, randomized, double-blind study evaluating ceftaroline fosamil for the treatment of patients with complicated skin and skin structure infections. J Antimicrob Chemother. 2010 Nov;65 Suppl 4:iv53-iv65. doi: 10.1093/jac/dkq255.
28. Dryden M, Zhang Y, Wilson D, et al. A Phase III, randomized, controlled, non-inferiority trial of ceftaroline fosamil 600 mg every 8 h versus vancomycin plus aztreonam in patients with complicated skin and soft tissue infection with systemic inflammatory response or underlying comorbidities. J Antimicrob Chemother. 2016 Dec;71 (12):3575-3584. doi: 10.1093/jac/dkw333.
29. Bosheva M, Gujabidze R, Károly É, et al. A Phase 3, Randomized, Investigator-blinded Trial Comparing Ceftobiprole With a Standard-of-care Cephalosporin, With or Without Vancomycin, for the Treatment of Pneumonia in Pediatric Patients. Pediatr Infect Dis J. 2021 Jun 1;40(6):e222-e229. doi: 10.1097/INF.0000000000003077
30. Blumer JL, Ghonghadze T, Cannavino C, et al. A Multicenter, Randomized, Observer-blinded, Active-controlled Study Evaluating the Safety and Effectiveness of Ceftaroline Compared With Ceftriaxone Plus Vancomycin in Pediatric Patients With Complicated Community-acquired Bacterial Pneumonia. Pediatr Infect Dis J. 2016 Jul;35(7): 760-6. doi: 10.1097/INF.0000000000001160
31. Korczowski B, Antadze T, Giorgobiani M, et al. A Multicenter, Randomized, Observer-blinded, Active-controlled Study to Evaluate the Safety and Efficacy of Ceftaroline Versus Comparator in Pediatric Patients With Acute Bacterial Skin and Skin Structure Infection. Pediatr Infect Dis J. 2016 Aug;35(8):e239-47. doi: 10.1097/INF.0000000000001191
32. Bradley JS, Stone GG, Chan PLS, et al. Phase 2 Study of the Safety, Pharmacokinetics and Efficacy of Ceftaroline Fosamil in Neonates and Very Young Infants With Late-onset Sepsis. Pediatr Infect Dis J. 2020 May;39(5):411-418. doi: 10.1097/INF.0000000000002607
33. Cannavino CR, Nemeth A, Korczowski B, et al. A Randomized, Prospective Study of Pediatric Patients With Community-acquired Pneumonia Treated With Ceftaroline Versus Ceftriaxone. Pediatr Infect Dis J. 2016 Jul;35(7):752-9. doi: 10.1097/INF.0000000000001159
34. Gentile I, Buonomo AR, Corcione S, et al. CEFTO-CURE study: CEFTObiprole Clinical Use in Real-lifE - a multi-centre experience in Italy. Int J Antimicrob Agents. 2023 Jul;62(1):106817. doi: 10.1016/j.ijantimicag.2023.106817
35. Zhanel GG, Kosar J, Baxter M, et al. Real-life experience with ceftobiprole in Canada: Results from the CLEAR (CanadianLEadership onAntimicrobialReal-life usage) registry. J Glob Antimicrob Resist. 2021 Mar;24:335-339. doi: 10.1016/j.jgar.2021.01.014
36. Mahmoud E, Al Mansour S, Bosaeed M, et al. Ceftobiprole for Treatment of MRSA Blood Stream Infection: A Case Series. Infect Drug Resist. 2020 Aug 3;13:2667-2672. doi: 10.2147/IDR.S254395
37. Giuliano S, Angelini J, D'Elia D, et al. Ampicillin and Ceftobiprole Combination for the Treatment of Enterococcus faecalis Invasive Infections: "The Times They Are A-Changin". Antibiotics (Basel). 2023 May 9;12(5):879. doi: 10.3390/antibiotics12050879
38. Hidalgo-Tenorio C, Pitto-Robles I, Arnés García D, et al. Cefto Real-Life Study: Real-World Data on the Use of Ceftobiprole in a Multicenter Spanish Cohort. Antibiotics (Basel). 2023 Jul 21;12(7):1218. doi: 10.3390/antibiotics12071218
39. Zampino R, Gallo R, Salemme A, et al. Clinical results with the use of ceftaroline and ceftobiprole: real-life experience in a tertiary care hospital. Int J Antimicrob Agents. 2023 Aug;62(2):106883. doi: 10.1016/j.ijantimicag.2023.106883
40. Bellut H, Arrayago M, Amara M, et al. Real-life use of ceftobiprole for severe infections in a French intensive care unit. Infect Dis Now. 2024 Feb; 54(1):104790. doi: 10.1016/j.idnow.2023.104790
41. Membrillo de Novales FJ, Falcone M, Soriano A, et al.; RETRACE Study Group. Safety of ceftobiprole in patients with impaired renal, hepatic or immune function: A multinational retrospective hospital chart review (RETRACE study). Int J Antimicrob Agents. 2025 Apr;65(4):107450. doi: 10.1016/j.ijantimicag.2025.107450
42. Pham TT, Mabrut E, Cochard P, et al. Cost of off-label antibiotic therapy for bone and joint infections: a 6-year prospective monocentric observational cohort study in a referral centre for management of complex osteo-articular infections. J Bone Jt Infect. 2021 Sep 7;6(8):337-346. doi: 10.5194/jbji-6-337-2021
43. Caniff KE, Judd C, Lucas K, et al. Heartfelt Impact: A Descriptive Analysis of Ceftaroline-Containing Regimens in Endocarditis due to Methicillin-Resistant Staphylococcus aureus. Infect Dis Ther. 2024 Dec;13(12):2649-2662. doi: 10.1007/s40121-024-01068-0.
44. Villa S, Escrihuela-Vidal F, Fernández-Hidalgo N, et al.; Ceftaroline MRSA Group Spain GEIRAS-SEIMC. Ceftaroline for bloodstream infections caused by methicillin-resistant Staphylococcus aureus: a multicentre retrospective cohort study. Clin Microbiol Infect. 2025 May; 31(5):793-801. doi: 10.1016/j.cmi.2024.11.022.
45. Geriak M, Haddad F, Rizvi K, et al. Clinical Data on Daptomycin plus Ceftaroline versus Standard of Care Monotherapy in the Treatment of Methicillin-Resistant Staphylococcus aureus Bacteremia. Antimicrob Agents Chemother. 2019 Apr 25;63(5):e02483-18. doi: 10.1128/AAC.02483-18
46. Talbot GH, Thye D, Das A, Ge Y. Phase 2 study of ceftaroline versus standard therapy in treatment of complicated skin and skin structure infections. Antimicrob Agents Chemother. 2007 Oct;51(10):3612-6. doi: 10.1128/AAC.00590-07
Об авторах
Ю. М. ГомонРоссия
Юлия Михайловна Гомон, д. м. н., профессор
кафедра клинической фармакологии и доказательной медицины
Санкт-Петербург
А. С. Петриченко
Россия
Анастасия Сергеевна Петриченко, студент
Санкт-Петербург
Рецензия
Для цитирования:
Гомон Ю.М., Петриченко А.С. Систематический обзор с метаанализом и непрямым сравнением результатов исследований по оценке эффективности и безопасности применения цефтобипрола и цефтаролина у взрослых пациентов в терапии инфекций различных локализаций. Реальная клиническая практика: данные и доказательства. 2025;5(2):40-57. https://doi.org/10.37489/2782-3784-myrwd-073. EDN: CNBYJS
For citation:
Gomon Yu.M., Petrichenko A.S. A systematic review with meta-analysis and indirect comparison of the results of studies evaluating the efficacy and safety of ceftobiprole and ceftaroline in adult patients in the treatment of infections of various localizations. Real-World Data & Evidence. 2025;5(2):40-57. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-073. EDN: CNBYJS
JATS XML






























