Перейти к:
Реализация микробиологического мониторинга для прогнозирования полирезистентного фенотипа респираторных изолятов на основе анализа факторов риска у пациентов с внебольничной пневмонией
https://doi.org/10.37489/2782-3784-myrwd-074
EDN: FUCCBB
Аннотация
Актуальность. Изучение факторов риска наличия полирезистентных возбудителей на региональном уровне, предопределяющих множественную устойчивость, является важной составляющей для персонализации применяемых стратегий эмпирической антимикробной терапии в рамках эпидемиологической безопасности.
Цель. Изучение и анализ факторов полирезистентности для оптимизации выбора эмпирической антимикробной терапии у пациентов с внебольничной пневмонией на региональном уровне.
Материалы и методы. У 533 пациентов с внебольничной пневмонией стационарного профиля ретроспективно оценивались клинические, микробиологические и молекулярно-генетические факторы риска наличия полирезистентных возбудителей регионального значения. Для прогнозирования влияния факторов риска на полирезистентность респираторных изолятов на региональном уровне применялся метод построения кривых ROC.
Результаты. Определены лидирующие респираторные изоляты в этиологии внебольничной пневмонии на региональном уровне. Продемонстрирован высокий уровень ассоциативной резистентности у респираторных изолятов Klebsiella pneumonia, Haemophylus influenzae, Escherichia coli, требующий облигатного проведения микробиологического и молекулярно-генетического тестирования для выбора стартовой антимикробной терапии. Частота продуцирования карбапенемаз у лидирующего этиологически значимого микроорганизма Klebsiella pneumonia составила 60 %; наличие множественности механизмов резистентности — 30 %, наличие металло-бета-лактамаз типа NDM составило 42 % соответственно. В построенных моделях прогнозирования практически значимыми факторами для реализации полирезистентности на региональном уровне стали: предшествующая госпитализация и антимикробная терапия, пребывание в учреждениях длительного ухода, предлеченность карбапенемными антибиотиками, ассоциативная продукция карбапенемаз с бета-лактамазами расширенного спектра.
Заключение. Полученные результаты показывают значимость комплексного анализа клинических и микробиологических факторов для прогнозирования фенотипа полирезистентности в условиях конкретной медицинской организации и оптимизации эмпирического выбора антимикробных препаратов.
Для цитирования:
Боброва О.П., Зырянов С.К., Черная В.В., Стаценко М.В., Парыгина О.А. Реализация микробиологического мониторинга для прогнозирования полирезистентного фенотипа респираторных изолятов на основе анализа факторов риска у пациентов с внебольничной пневмонией. Реальная клиническая практика: данные и доказательства. 2025;5(2):58-71. https://doi.org/10.37489/2782-3784-myrwd-074. EDN: FUCCBB
For citation:
Bobrova O.P., Zyryanov S.K., Chernaya V.V., Statsenko M.V., Parygina O.A. Implementation of microbiological monitoring for predicting the multidrug-resistant phenotype of respiratory isolates based on risk factor analysis in patients with community-acquired pneumonia. Real-World Data & Evidence. 2025;5(2):58-71. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-074. EDN: FUCCBB
Введение / Introduction
Особенности тенденций микробного пейзажа внебольничной пневмонии с одновременным ростом резистентности к антимикробным препаратам у причинно-значимых возбудителей в современных условиях, несмотря на имеющиеся возможности этиотропной диагностики, диктуют проведение, как правило, стартовой эмпирической антимикробной терапии [1]. Микробиологическое разнообразие возможных возбудителей внебольничной пневмонии, сроки проведения микробиологических и молекулярно-генетических исследований в медицинских организациях, известность факторов риска полирезистентности предопределяют возможности персонализированного выбора эмпирической антимикробной терапии у пациентов с инфекцией нижних дыхательных путей на примере внебольничной пневмонии [2].
Персонализация в каждой медицинской организации факторов риска полирезистентных возбудителей, предопределяющих множественную устойчивость к применяемых классам антимикробных препаратов, является важной составляющей для рационализации антимикробной терапии и влияния на прогноз заболевания [3][4]. Изучение структуры причинно-значимых возбудителей, а также мониторирование резистентности в каждой медицинской организации является неотъемлемой частью эпидемиологической безопасности в рамках риск-ориентированного подхода [5][6]. Изучение приоритетных факторов риска полирезистентности возбудителей внебольничной пневмонии на региональном уровне в части взаимовлияния микробиологических и клинических факторов риска имеет актуальное значение для стратегии сдерживания антимикробной резистентности, достижения эффективности лечения [7-9].
Цель исследования / Objective — изучение и анализ факторов полирезистентности для оптимизации выбора эмпирической антимикробной терапии у пациентов с внебольничной пневмонией на региональном уровне.
Материалы и методы / Materials and methods
В ретроспективное исследование включены 533 пациента с внебольничной пневмонией, получивших лечение в стационарных условиях многопрофильной медицинской организации ФГБУ «Федеральный Сибирский Научно-клинический центр Федерального медико-биологического агентства» (ФСНКЦ ФМБА) в 2024 году. Все пациенты, включённые в исследование, были госпитализированы бригадами скорой медицинской помощи. Тяжесть внебольничной пневмонии и необходимость госпитализации в палату интенсивной терапии определялась по шкале SMARTCO [10]. Средний возраст пациентов составил 55,73±19,29 лет. Все пациенты проходили стандартное клинико-лабораторное обследование согласно клиническим рекомендациям «Внебольничная пневмония у взрослых» (2024 г.) [3]. Гендерная структура пациентов характеризовалась статистически незначимыми различиями между мужчинами (56 %) и женщинами (44 %) р=0,09.
Микробиологический анализ: забор биоматериала для микробиологического исследования осуществлять в соответствии с утверждённым локальным протоколом ФСНКЦ ФМБА (Красноярск) «Алгоритм взятия мокроты / трахеального аспирата на микробиологическое (культуральное) исследование А. 2024–16.2–01». Оценка чувствительности микроорганизмов к антимикробным препаратам проводилась в соответствии с российскими рекомендациями «Определение чувствительности микроорганизмов к антимикробным препаратам, версия 2024–02, рекомендациями Европейского комитета по определению чувствительности к антимикробным препаратам (EUCAST, v. 15.0), 2024 г. [11]. Минимальную ингибирующую концентрацию полирезистентных микроорганизмов определяли методом серийных разведений. Фенотипический скрининг наличия продукции факторов резистентности проводили с использованием коммерческих наборов диско-диффузионным методом с оценкой по критериям EUCASTv. 15.0. Фенотипы резистентности определялись как полирезистентные (MDR) — нечувствительные более чем к трём классам различных антимикробных препаратов, экстремально (чрезвычайно) резистентные (XDR) — чувствительные не более чем к 1–2 классам различных антимикробных препаратов, панрезистентные (PDR) — резистентные ко всем классам антимикробных препаратов [12].
Молекулярно-генетический анализ: для быстрой этиологической диагностики из биоматериала с задней стенки глотки определяли ДНК Mycoplasma pneumoniae, Chlamydophila pneumoniae, Streptococcus pneumoniae, Haemophilus influenzae методом ПЦР с помощью гибридизационно-флуоресцентной детекции в режиме «реального времени».
Гены резистентности микроорганизмов определялись методом ПЦР (гибридизационно-флуоресцентная детекция в режиме реального времени) в соответствии с МУ 1.3.2569–09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I–IV групп патогенности» [13]. Материалом для ПЦР служила ДНК, выделенная из образцов бактериальных культур, полученных путём посева биологического материала на плотную или жидкую питательную среду.
Статистические методы: обработку полученных данных проводили с применением программы IBM SPSS Statistics 20.0 (США). Нормальность распределения оценивали с помощью критерия Колмогорова-Смирнова. Непараметрические данные представлялись в виде медианы 1-го, 3-го квартилей; параметрические — в виде среднего арифметического и стандартного отклонения. Различия считались достоверными при уровне значимости p <0,05. Применялся метод прогнозирования с построением кривых ROC, для оценки качества которых рассчитывались чувствительность (Se), специфичность (Sp = 1 — Sp) и точность (Accuracy), а также определение границы оптимального близкого соотношения специфичности и чувствительности (порог отсечения — optimal cut-off value), позволяющей применять модель на практике. Качество кривых ROC оценивали по экспертной шкале для значений AUC, где значения 0,5–0,6 соответствовали неудовлетворительному; 0,6–0,7 — среднему; 0,7–0,8 — хорошему; 0,8–0,9 — очень хорошему; 0,9–1 — отличному качеству, соответственно. При р <0,05 асимптоматической значимости и >0,5 ДИ 95 % принималась гипотеза о прогностической значимости модели.
Результаты / Results
Клиническая характеристика наблюдаемых пациентов представлена в табл. 1.
Таблица 1. Клиническая характеристика пациентов с внебольничной пневмонией, n=533 Table 1. Clinical characteristics of patients with community-acquired pneumonia, n=533 | |
Показатели | |
Возраст, лет (M±σ) | 55,73±19,29 |
Мужчины, n (%) | 299 (56) |
Женщины, n (%) | 234 (44) |
Индекс массы тела, кг/м2 (M±σ) | 26,42±4,81 |
Показатели | |
Билирубин, мкмоль/л (M±σ) | 23,11±8,81 |
АСТ, ед (M±σ) | 60,31±87,93 |
АЛТ, ед (M±σ) | 42,04±19,14 |
СКФ CKD-EPI, мл/мин (M±σ) | 84,67±19,09 |
Альбумин, г/л (M±σ) | 26,76±5,05 |
SpO2, % (Ме: Р25; Р75) | 89,30 (78;98) |
Чайльд Пью, баллы (M±σ) | 5,58±1,33 |
СКАТ2, n (%) | 474 (89) |
Прокальцитонин, нг/мл (Ме: Р25; Р75) | 10,16 (2;42) |
Лейкоциты в мкл (Ме: Р25; Р75) | 11755 (3200;26000) |
Лимфоциты относит., % (Ме: Р25; Р75) | 18,26 (2,2;49) |
Тяжелая пневмония, n (%) | 91 (17) |
Среднетяжелая пневмония, n (%) | 442 (83) |
Полисегментарность пневмонии, n (%) | 442 (83) |
ХОБЛ, n (%) | 64 (12) |
Эндокринопатии, n (%) | 229 (43) |
Вирусные инфекции, n (%) | 27 (5) |
Инфекция МВП, n (%) | 117 (22) |
ССЗ, n (%) | 341 (64) |
Вторичное иммунодефицитное состояние (ВИЧ-инфекция), n (%) | 69 (13) |
Индекс Charlson, баллы (M±σ) | 3,93±1,49 |
Примечания: АСТ — аспартатаминотрансфераза; АЛТ — аланинаминотрансфераза; СКФ — скорость клубочковой фильтрации; СКАТ — стратегия контроля антимикробной терапии; ХОБЛ — хроническая обструктивная болезнь лёгких; МВП — мочевыводящие пути; ССЗ — сердечно-сосудистые заболевания; ВИЧ — вирус иммунодефицита человека. Notes: AST — aspartate aminotransferase; ALT — alanine aminotransferase; GFR — glomerular filtration rate; AMS — antimicrobial therapy control strategy; COPD — chronic obstructive pulmonary disease; UTI — urinary tract; CVD — cardiovascular disease; HIV — human immunodeficiency virus. | |
Учитывая известную этиологическую структуру внебольничной пневмонии согласно клиническим рекомендациям «Внебольничная пневмония у взрослых» (2024 г.) были выделены отличительные особенности по изучаемым причинно-значимым возбудителям инфекции нижних дыхательных путей на примере внебольничной пневмонии у пациентов ФСНКЦ ФМБА (рис. 1). Лидирующим причинно-значимым микроорганизмом в этиологии внебольничной пневмонии госпитализированных пациентов определена Klebsiella pneumoniae, частота выделения которой составляет 40 %. Candida albicans — одноименная по частоте выделения (40 %), не представляла причинной значимости в этиологии госпитализированной внебольничной пневмонии с учётом применяемых критериев клинической значимости количественных значений колониеобразующих единиц в мл [КОЕ/мл] согласно клинических рекомендаций по внебольничной пневмонии [3] и определена как колонизационная составляющая. Второе и третье место среди лидирующих микроорганизмов принадлежало Staphylococcus aureus и Streptococcus pneumonia соответственно. Частота выделения грамотрицательных возбудителей (Haemophylus influenzae, Escherichia coli, Pseudomonas aeruginosae) составила не более 18 %. На долю вирусно-бактериальных ассоциаций возбудителей внебольничной пневмонии, а также атипичных возбудителей (Mycoplasma pneumoniae, Chlamydophila pneumoniae) пришлось не более 5 % соответственно.
Анализ уровня резистентности ведущего возбудителя Klebsiella pneumoniae внебольничной пневмонии в 2024 г. продемонстрировал довольно высокий уровень резистентности выделенных изолятов микроорганизмов с лидированием защищённых аминопенициллинов, цефалоспорина 4-го поколения (цефепим), фторхинолонов (лево-, ципрофлоксацин), эртапенема (табл. 2). Аминогликозиды и карбапенемы (меропенем, имипенем/циластатин) могут рассматриваться в качестве стартовой терапии с учётом уровня сохранённой чувствительности только по результатам микробиологических исследований, что необходимо учитывать при стартовой эмпирической антимикробной терапии.
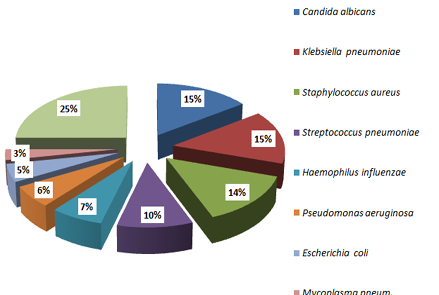
Рис. 1. Особенности этиологической структуры внебольничной пневмонии на региональном уровне
Fig. 1. Peculiarities of the etiological structure of community-acquired pneumonia at the regional level
Примечания: * — структура причинно-значимых изолятов у пациентов на региональном уровне; ** — структура причинно-значимых изолятов согласно клиническим рекомендациям Минздрава РФ [16].
Notes: * — structure of causative isolates in patients at the regional level; ** — structure of causally significant isolates according to clinical recommendations of the Ministry of Health of the Russian Federation [16].
Таблица 2. Чувствительность респираторных изолятов Klebsiella pneumoniae у пациентов с внебольничной пневмонией, n=533 Table 2. Sensitivity of Klebsiella pneumoniae respiratory isolates in patients with community-acquired pneumonia, n=533 | |||
Антимикробные препараты | % R | % I | % S |
амикацин | 44 | 17 | 39 |
гентамицин | 38 | 35 | 27 |
амоксициллин/клавулановая кислота | 91 | 2 | 7 |
азтреонам | 49 | 0 | 51 |
имипенем/циластатин | 64 | 9 | 27 |
ампициллин/сульбактам | 82 | 0 | 17 |
меропенем | 67 | 11 | 22 |
цефепим | 82 | 3 | 15 |
левофлоксацин | 82 | 0 | 18 |
цефтриаксон | 78 | 6 | 16 |
ципрофлоксацин | 82 | 0 | 18 |
эртапенем | 95 | 0 | 5 |
цефтазидим | 38 | 0 | 62 |
Проведённый анализ продемонстрировал отсутствие в этиологии внебольничной пневмонии метициллинрезистентного золотистого стафилококка при наличии высокого уровня резистентности выделенных изолятов Staphylococcus aureus к фторхинолонам (в 91 % изоляты, чувствительные при повышенной экспозиции к левофлоксацину, в 67 % — к ципрофлоксацину соответственно) (табл. 3). Уровень резистентности к аминогликозидам и кларитромицину, превышающий критический порог для возможного эмпирического применения, диктует также необходимость микробиологической детекции с определением чувствительности / резистентности).
Таблица 3. Чувствительность респираторных изолятов Staphylococcus aureus у пациентов с внебольничной пневмонией, n=533 Table 3. Sensitivity of Staphylococcus aureus respiratory isolates in patients with community-acquired pneumonia, n=533 | |||
Антимикробные препараты | % R | % I | % S |
амикацин | 30 | 0 | 70 |
цефуроксим | 2 | 0 | 98 |
амоксициллин/клавулановая кислота | 2 | 0 | 98 |
гентамицин | 19 | 0 | 81 |
имипенем/циластатин | 2 | 0 | 98 |
кларитромицин | 30 | 0 | 70 |
левофлоксацин | 0 | 91 | 9 |
меропенем | 2 | 0 | 98 |
моксифлоксацин | 0 | 2 | 98 |
эртапенем | 2 | 0 | 98 |
цефазолин | 2 | 0 | 98 |
ципрофлоксацин | 0 | 67 | 33 |
Низкий уровень резистентности выделенных респираторных изолятов пневмококка к аминопенициллинам, цефалоспоринам, макролидам не соответствует высокому проценту выделенных изолятов пневмококка категории I — чувствительные при повышенной экспозиции к левофлоксацину, что является не безопасным при эмпирическом применении данного антимикробного препарата (табл. 4).
Для выделенных респираторных изолятов Haemophylus influenzae определена категория I (чувствительные при повышенной экспозиции) в 45 % для амоксициллина/клавуланата, 32 % — для пиперациллина/тазобактама соответственно при сохранении чувствительности к левофлоксацину (86 %), цефалоспоринам 3–4 поколения (82 %), эртапенему (82 %), меропенему (100 %) (табл. 5).
Таблица 4. Чувствительность респираторных изолятов Streptococcus pneumoniae у пациентов с внебольничной пневмонией, n=533 Table 4. Sensitivity of respiratory isolates of Streptococcus pneumoniae in patients with community-acquired pneumonia, n=533 | |||
Антимикробные препараты | % R | % I | % S |
азитромицин | 25 | 0 | 75 |
амоксициллин | 4 | 10 | 86 |
амоксициллин/клавулановая кислота | 4 | 3 | 93 |
левофлоксацин | 11 | 89 | 0 |
ампициллин | 7 | 4 | 89 |
ампициллин/сульбактам | 4 | 3 | 93 |
пиперациллин/тазобактам | 4 | 3 | 93 |
моксифлоксацин | 4 | 0 | 96 |
цефепим | 4 | 3 | 93 |
цефотаксим | 4 | 3 | 93 |
цефтриаксон | 4 | 3 | 93 |
эртапенем | 4 | 0 | 96 |
Таблица 5. Чувствительность респираторных изолятов Haemophylus influenzae у пациентов с внебольничной пневмонией, n=533 Table 5. Sensitivity of Haemophylus influenzae respiratory isolates in patients with community-acquired pneumonia, n=533 | |||
Антимикробные препараты | % R | % I | % S |
амоксициллин/клавулановая кислота | 14 | 45 | 41 |
левофлоксацин | 9 | 0 | 86 |
меропенем | 0 | 0 | 100 |
пиперациллин/тазобактам | 9 | 32 | 50 |
цефепим | 14 | 4 | 82 |
цефтриаксон | 9 | 0 | 91 |
цефуроксим | 17 | 5 | 78 |
ципрофлоксацин | 9 | 5 | 86 |
эртапенем | 0 | 8 | 82 |
Высокий уровень резистентности определен для выделенных изолятов Escherichia coli у амоксициллина (82 %), амоксициллина/клавуланата (73 %), цефепима и цефтриаксона (53 %), что косвенно демонстрирует наличие механизмов резистентности и требует оптимизации антимикробной терапии (табл. 6).
Высокий уровень резистентности у пятого по частоте выделенных изолятов Pseudomonas aeruginosae продемонстрирован к амикацину (50 %), имипенему (63 %), меропенему (50 %), цефепиму (33 %), ципрофлоксацину (75 %), цефтазидиму (63 %), что демонстрирует также полирезистентность данных изолятов (табл. 7).
Таблица 6. Чувствительность (%) респираторных изолятов Escherichia coli у пациентов с внебольничной пневмонией, n=533 Table 6. Sensitivity of Escherichia coli respiratory isolates in patients with community-acquired pneumonia, n=533 | |||
Антимикробные препараты | % R | % I | % S |
амикацин | 13 | 0 | 87 |
амоксициллин | 82 | 6 | 12 |
амоксициллин /клавуланат | 73 | 0 | 27 |
гентамицин | 20 | 13 | 67 |
имипенем/циластатин | 7 | 0 | 93 |
ампициллин/сульбактам | 13 | 54 | 33 |
меропенем | 13 | 0 | 87 |
фосфомицин | 0 | 10 | 90 |
цефепим | 53 | 0 | 47 |
эртапенем | 0 | 0 | 100 |
цефтриаксон | 53 | 0 | 47 |
ципрофлоксацин | 33 | 14 | 53 |
Таблица 7. Чувствительность (%) респираторных изолятов Pseudomonas aeruginosae у пациентов с внебольничной пневмонией, n=533 Table 7. Чувствительность (%) респираторных изолятов Pseudomonas aeruginosae у пациентов с внебольничной пневмонией, n=533 | |||
Антимикробные препараты | % R | % I | % S |
амикацин | 50 | 0 | 50 |
имипенем | 63 | 13 | 24 |
меропенем | 50 | 0 | 50 |
цефепим | 32,5 | 58,5 | 9 |
ципрофлоксацин | 75 | 12,5 | 12,5 |
цефтазидим | 62,5 | 0 | 37,5 |
Фенотипы резистентности / Resistance phenotypes
Анализ структуры выделенных фенотипов респираторных изолятов приоритетного возбудителя внебольничной пневмонии на региональном уровне Klebsiella pneumonia продемонстрировал статистически значимое (р ≤0,001) лидирование фенотипа чрезвычайной (экстремальной) резистентности (рис. 2), что предопределяет применение современных стратегий антимикробной терапии для преодоления резистентности [14-16]. Мультирезистентный (MDR), дикий (WT), панрезистентный (PDR) фенотипы по частоте не имели статистически значимых различий (р ≥0,05).
Количество карбапенемрезистентных изолятов Klebsiella pneumonia (микробиологическая резистентность хотя бы к одному из тестируемых карбапенемов) у пациентов с внебольничной пневмонией составило 33 штамма в абсолютных цифрах, что составляет 16 % от общего числа исследованных респираторных изолятов Klebsiella pneumonia и требует использования антимикробных технологий для её преодоления, а также характеризуется наличием клинических факторов риска наличия полирезистентных возбудителей согласно стратегии контроля антимикробной терапии (СКАТ) у данной группы пациентов [17].
Наибольший практический интерес представляет детекция механизмов резистентности у ведущего респираторного изолята Klebsiella pneumonia, по результатам которой продемонстрировано наличие многообразия ассоциаций механизмов резистентности с общей частотой 60 %. Лидирующими механизмами резистентности определены карбапенемазы типа NDM в моно- и ассоциированных вариантах (рис. 3).
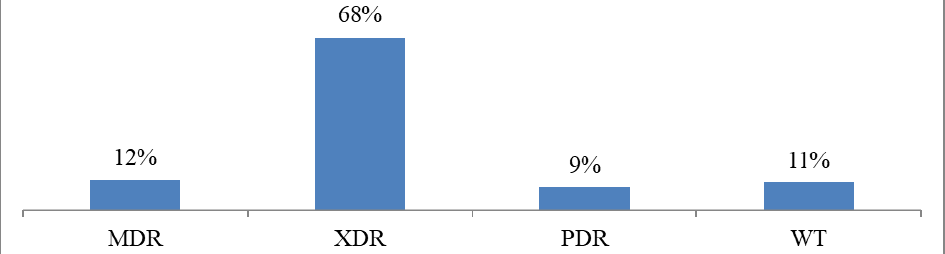
Рис. 2. Структура фенотипов респираторных изолятов Klebsiella pneumoniae
Fig. 2. Phenotype structure of respiratory isolates of Klebsiella pneumoniae
Примечания: MDR — мультирезистентный фенотип; XDR — экстремальнорезистентный фенотип; PDR — панрезистентный фенотип; WT — дикий фенотип.
Notes: MDR — multidrug-resistant phenotype; XDR — extremely resistant phenotype; PDR — pandrug-resistant phenotype; WT — wild phenotype.
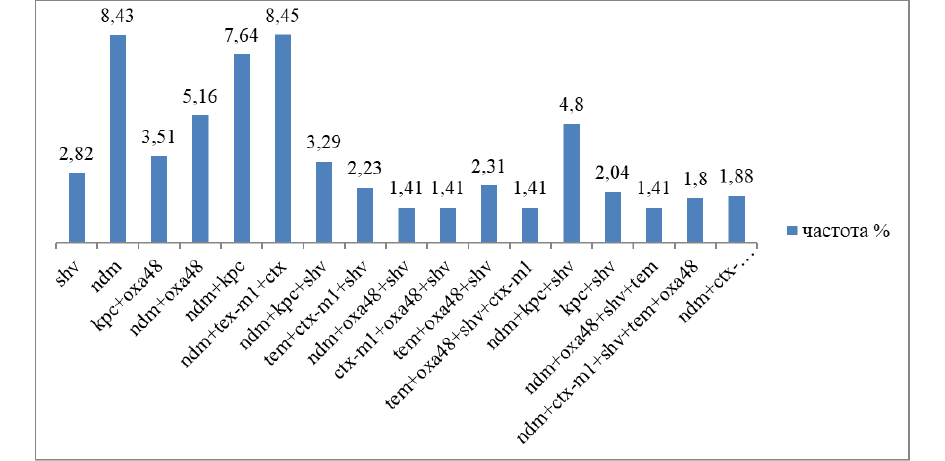
Рис. 3. Частота (%) механизмов резистентности у респираторных изолятов Klebsiella pneumoniae, n=213
Fig. 3. Frequency (%) of resistance mechanisms in respiratory isolates of Klebsiella pneumoniae, n=213
Частотный анализ факторов риска полирезистентных возбудителей согласно программы СКАТ, 2018 г. [17] и методических рекомендаций «Диагностика и антимикробная терапия инфекций, вызванных полирезистентными микроорганизмами» (обновление 2024 года) [18] продемонстрировал некоторую их общность для прогнозирования факторов риска полирезистентных возбудителей энтеробактерий (Klebsiella pneumoniaе), пенициллинрезистентного Streptococcus pneumoniae, полирезистентной Pseudomonas aeruginosae на региональном уровне в ФСНКЦ ФМБА (Красноярск), что предопределило дальнейшие этапы проведения комплексного анализа (табл. 8).
Таблица 8. Структура приоритетных факторов риска наличия полирезистентных возбудителей Table 8. Structure of priority risk factors for the presence of multidrug-resistant pathogens |
Предшествующая госпитализация ≤3 мес. назад |
Предшествующая антимикробная терапия ≤3 мес. назад |
Пребывание в учреждениях длительного ухода |
Коморбидность более 3 баллов по Charlson |
Предлеченность менее 3 мес. назад карбапенемными антибиотиками |
Пожилой возраст старше 65лет |
Вторичная иммунная недостаточность |
Пол |
Таким образом, незначимыми факторами риска регионального значения были следующие: контакт с детьми из детских дошкольных учреждений/многодетные семьи (имеющие более 3 детей); недавнее оперативное лечение; проведение антиретровирусной терапии (ВИЧ); бронхоэктазы; терапия в фармакодинамических дозах глюкокортикостероидов; предшествующая колонизация / инфекция Pseudomonas aeruginosae; наличие сахарного диабета; тяжёлая ХОБЛ; инфекция, вызванная β-лактамазами расширенного спектра (БЛРС) в анамнезе (анамнестически менее 3 мес. леченные по внебольничной пневмонии БЛРС-ассоциированной).
Прогнозирование факторов риска полирезистентности / Prediction of risk factors for multidrug resistance
Построенная модель прогнозирования формирования полирезистентного фенотипа респираторных изолятов с учётом анализируемых факторов риска характеризовалась хорошим качеством по уровню площади под фармакокинетической кривой (AUC 0,86), чувствительности, специфичности и точности (рис. 4).
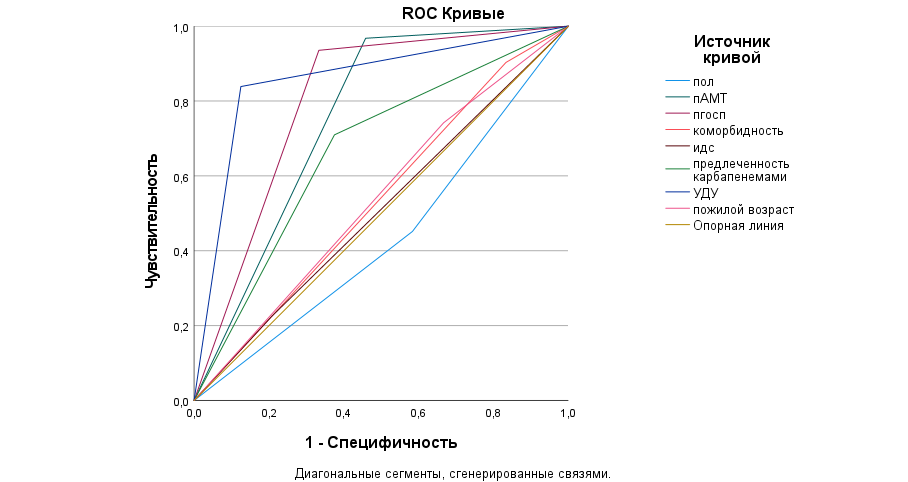
Рис. 4. Кривая ROC прогнозирования риска полирезистентности грамотрицательных респираторных изолятов в зависимости от факторов риска у пациентов с внебольничной пневмонией, n=213
Fig. 4. ROC risk prediction curve for multidrug resistance of gram-negative respiratory isolates depending on risk factors in patients with community-acquired pneumonia, n=533
Примечания: пАМТ — предшествующая антимикробная терапия; пгосп — предшествующая госпитализация; идс — иммунодефицитное состояние; УДУ — учреждения длительного ухода.
Notes: pAMT — previous antimicrobial therapy; phosp — previous hospitalization; idc — immunodeficiency state; LTC — long-term care facilities.
Анализ качества построенных моделей по площади кривой ROC продемонстрировал практическое значение для реализации полирезистентного фенотипа следующих факторов: предшествующая госпитализация [р=0,000; 95 % ДИ: 0,67–0,93]; точка отсечения (Cutoff) 4,2 мес.); предшествующая антимикробная терапия [р=0,001; 95 % ДИ: 0,62–0,89] (точка отсечения (Cutoff) 3,5 мес.), пребывание в учреждениях длительного ухода [р=0,000; 95 % ДИ: 0,75–0,97], предлеченность менее 3 мес. назад карбапенемами [р=0,035; 95 % ДИ: 0,52–0,81]. Другие анализируемые факторы риска (пол, иммунодефицитное состояние, коморбидность и возраст старше 65 лет) не продемонстрировали статистически значимого влияния в моделях прогнозирования.
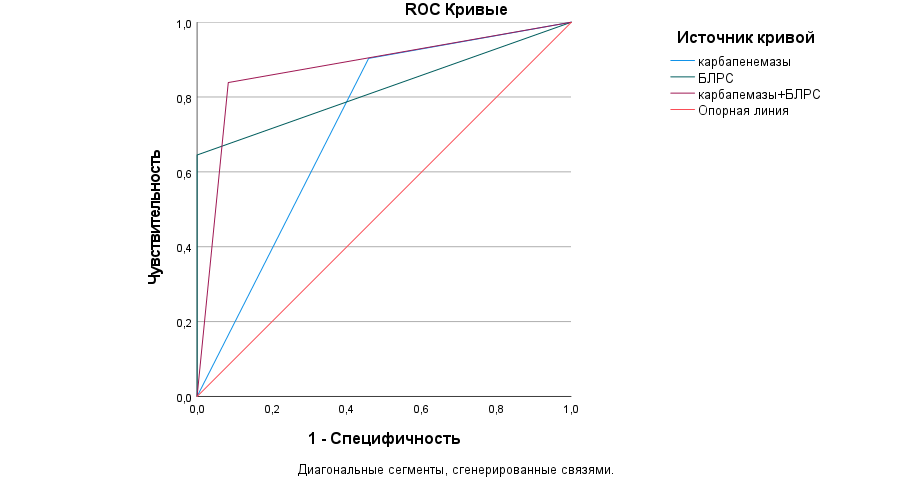
Рис. 5. Кривая ROC прогнозирования риска полирезистентности грамотрицательных респираторных изолятов в зависимости от микробиологических факторов риска у пациентов с внебольничной пневмонией, n=213
Fig. 5. ROC curve for predicting the risk of polyresistance of gram-negative respiratory isolates depending on microbiological risk factors in patients with community-acquired pneumonia, n=213
Примечание: БЛРС — β-лактамазы расширенного спектра действия.
Note: ESBL — extended spectrum β-lactamases.
Анализируя микробиологические показатели (механизмы резистентности — карбапенемазы и β-лактамазы расширенного спектра и их сочетание) выделенных грамотрицательных изолятов, построенная кривая ROC продемонстрировала практическую значимость с высокой чувствительностью (0,839), специфичностью (0,917) для ассоциации БЛРС и карбапенемаз [р=0,000; 95 % ДИ: 0,78–0,98]. Построенная прогностическая модель для БЛРС [р=0,000; 95 % ДИ: 0,71–0,94] не имела практической значимости из-за нулевой специфичности. Влияние карбапенемаз на формирование полирезистентности характеризовалось высокой чувствительностью (0,903), однако низкой специфичностью (0,542), что не позволяет применять полученную зависимость на практике, несмотря на статистическую значимость по асимптоматической значимости 0,005 и 95 % ДИ: 0,58–0,87 (рис. 5).
Обсуждение / Discussion
Известную значимость микробиологических исследований трудно переоценить в современных условиях в реальной клинической практике, в том числе и для пациентов с внебольничной пневмонией [18][19]. Выявленные региональные особенности причинно-значимых возбудителей внебольничной пневмонии демонстрируют одновременно региональные особенности и имеющиеся угрозы антибиотикорезистентности внебольничной инфекции [20]. Имеющиеся на сегодняшний день представления о гипервирулентности внебольничной Klebsiella pneumonia [21], а также её трансформации в панрезистентную не были подтверждены по результатам стринг-теста, отсутствия возможности детекции других молекулярно-генетических маркеров гипервирулентности, а также по клиническому течению с отсутствием множественности поражения и уровню атрибутивной летальности в пределах 6,7 % в ФСНКЦ ФМБА г. Красноярска. Приоритетная роль Klebsiella pneumonia, MSSA, Streptococcus pneumoniae в этиологии внебольничной пневмонии на региональном уровне наряду с грамотрицательными возбудителями (E. coli, H. influenzae, P. aeruginosae) соответствует возможной структуре возбудителей на территории РФ, но значимо отличается по частотным характеристикам, что обеспечивает изменение структуры применяемых антимикробных препаратов у данных пациентов в сравнении с рекомендованными, принимая во внимание наличие механизмов резистентности у Klebsiella pneumonia [1]. Необходимо также учитывать, что выделенные изоляты Streptococcus pneumoniae, Haemophylus influenzae, Mycoplasma pneumoniae, Chlamydophila pneumoniae с помощью ПЦР исследования с задней стенки глотки в 35 % случаев не совпадали с результатами подтверждающего микробиологического исследования, что свидетельствует о возможной колонизации верхних дыхательных путей [22] и недостоверности причинно-значимой составляющей, что нередко подтверждалось отсутствием клинической эффективности антистрептококковых препаратов (β-лактамные антибиотики, макролиды) при наличии клинико-микробиологического эффекта антимикробных препаратов, включающих в спектр активности грамотрицательные микроорганизмы [23][24]. Процент изолятов Streptococcus pneumoniae категории I (чувствительные при повышенной экспозиции) к левофлоксацину составил в нашем исследовании 89 %, что не противоречит результатам общероссийского исследования «SPECTRUM» (99,3 %) [1], что определяет применение данного антимикробного препарата только в суточной дозе не менее 1000 мг у данной категории пациентов, не противоречат клиническим рекомендациям. Уровень резистентности внебольничных изолятов Klebsiella pneumonia является достаточно высоким, значимо преодолевая порог отсечения в 20 % для эмпирического применения практически всех стандартно используемых групп антимикробных препаратов, что свидетельствует о некой внебольничной «условности» за счёт де-маршрутизации данных пациентов на территории города Красноярска (предлеченные амбулаторно или стационарно по внебольничной пневмонии и госпитализируемые в срок до 3 недель после предшествующей выписки из других медицинских организаций). Уровень резистентности респираторной Klebsiella pneumoniaе в ФСНКЦ ФМБА значимо отличается от общероссийских данных, превалируя по резистентности к аминогликозидам, карбапенемам, цефалоспоринам четвёртого поколения, фторхинолонам и цефалоспоринам третьего поколения, демонстрируя резистентность, характерную для нозокомиальных штаммов Klebsiella pneumoniaе, показанную в многоцентровом эпидемиологическом исследовании в стационарах РФ [25]. Выделенные респираторные изоляты MSSA характеризовались чувствительностью с повышенной экспозицией также к левофлоксацину в 91 %; резистентностью с превышением порога отсечения в 20 % и более — для кларитромицина и амикацина, что исключало их из перечня возможных антимикробных препаратов для эмпирической терапии у пациентов на фоне сахарного диабета, после перенесённого гриппа или респираторной вирусной инфекции прежде всего. Уровень резистентности MSSA в этиологии инфекций респираторного тракта не превышает 9,82 % к β-лактамам и 6,36 % к фторхинолонам [16]. Респираторные изоляты гемофильной палочки отличались высокой резистентностью к пиперациллину/тазобактаму и амоксициллину/клавуланату, что является также региональной особенностью, демонстрируя наличие возможных механизмов полирезистентности у данного микроорганизма и расширяя возможности применения защищенных цефалоспоринов 3 и 4 поколений. Респираторные изоляты кишечной палочки значимо превышали по резистентности общероссийские данные в части амоксициллин/клавулановая кислота (73 против 42,74 %), демонстрируя незначимые различия в части цефалоспоринов 3 поколения (53 против 52 %), цефалоспорины 4 поколения (53 против 52,8 %) [16]. Выделенные изоляты синегнойной палочки демонстрировали довольно высокий уровень резистентности к амикацину (53 %), цефалоспорину 3 поколения (цефтазидиму — 65 %) и 4 поколения (38 %), а также к карбапенемам (имипенему — 68 %, меропенему — 53 %) и ципрофлоксацину — 78 %, что значимо на практике может ограничивать возможности антимикробной терапии, предопределяя тем самым независимые факторы для неблагоприятного исхода [26].
Таким образом, были выделены и обозначены основные региональные микробиологические особенности у пациентов с внебольничной пневмонией: лидирование в структуре возбудителей внебольничной пневмонии — Klebsiella pneumoniae и MSSA, отсутствие лидирующего значения пневмококка и минимальные частотные показатели атипичных возбудителей (Mycoplasma pneumoniae, Chlamydophila pneumoniae) в структуре возбудителей; выделенные респираторные изоляты Klebsiella pneumoniae демонстрируют ассоциативную резистентность и требуют микробиологического и молекулярно-генетического тестирования для обеспечения эффективности антимикробной терапии; Pseudomonas aeruginosae, ассоциированная с внебольничной пневмонией на региональном уровне, характеризуется также множественной резистентностью.
Уровень продукции карбапенемаз у респираторных изолятов Klebsiella pneumoniae составляет 60 %. Превалирующим механизмом резистентности у выделенных изолятов Klebsiella pneumoniae является сочетание продукции карбапенемаз с БЛРС — 30 % (множественная резистентность) (сериновые класс D). Частота продукции сериновых карбапенемаз класса С (AmpC) составляет 0 %. Основными металло-β-лактамазами являются NDM при тотальном отсутствии продукции VIM и IMP. Частота продукции NDM составляет 42 %. Наличие выявленной множественной резистентности у внебольничных респираторных изолятов предопределило изучение практической значимости факторов риска формирования полирезистентных фенотипов с целью дифференцированного выбора стартовой эмпирической антимикробной терапии на региональном уровне. Предшествующая госпитализация (менее 4,2 мес. назад), предшествующая антимикробная терапия (менее 3,5 мес. назад), пребывание в учреждениях длительного ухода, предлеченность карбапенемами, ассоциация карбапенемаз и БЛРС — факторы риска регионального значения для выбора стратегий эмпирической антимикробной терапии по полирезистентному фенотипу. Результаты микробиологического мониторинга респираторных изолятов и механизмов резистентности должны лечь в основу персонализированного выбора стартовой эмпирической антимикробной терапии у пациентов с прогностически значимыми факторами риска полирезистентности с обязательным исключением из схем эмпирической терапии левофлоксацина и замены его на моксифлоксацин, исключением амоксициллина/клавуланата, пиперациллина/тазобактама и замены их на защищённые цефалоспорины 3 или 4 поколений, карбапенемы I, II группы. У пациентов с предлеченностью карбапенемами необходимо рассматривать комбинированные эмпирические режимы терапии, включающие комбинацию защищённых цефалоспоринов 3 поколения (цефтазидим/авибактам) или 4 поколения (цефепим/сульбактам) с азтреонамом.
Заключение / Conclusion
Полученные результаты показывают значимость комплексного анализа клинических и микробиологических факторов для оценки наличия фенотипа полирезистентности [11][13][17]. Возможность прогнозирования фенотипа резистентности в условиях конкретной медицинской организации является инструментом, позволяющим не только стратифицировать пациентов по наиболее значимым факторам риска на региональном уровне, а также персонализировать стартовый выбор антимикробных препаратов [14]. Выявленные пороговые значения наиболее практически значимых факторов риска должны лечь в основу персонализации процесса выбора антимикробной терапии у пациентов с внебольничными инфекциями нижних дыхательных путей.
Список литературы
1. Козлов Р.С., Муравьев А.А., Чагарян А.Н., Иванчик Н.В., Куркова А.А., Кузьменков А.Ю., Трушин И.В., Сухорукова М.В., Цветкова И.А., Морозова О.А., Кириллова Г.Ш., Попова Л.Д., Москвитина Е.Н., Петрова Т.А., Мартьянова Н.М., Ершова М.Г., Быконя С.А. Эпидемиология и антибиотикорезистентность серотипов S. pneumoniae, циркулирующих во взрослой популяции на территории Российской Федерации (исследование «SPECTRUM»). Клиническая микробиология и антимикробная химиотерапия. 2021;23(2):127-137. doi: 10.36488/cmac.2021.2.127-137.
2. Рачина С.А., Купрюшина О.А., Стрелкова Д.А., Авдеев С.Н., Власенко А.Е., Яснева А.С., Юданова Т.А., Трофименко И.Н., Антонов В.Н., Агибалова М.Н., Мержоева З.М., Яцышина С.Б., Тихонова М.А., Елькина М.А., Ананичева Н.А., Бурмистрова Е.Н., Сухорукова М.В. Этиология внебольничной пневмонии у взрослых в стационарах РФ после пандемии COVID-19: результаты многоцентрового проспективного исследования. Клиническая микробиология и антимикробная химиотерапия. 2024;26(2):141-147 doi: 10.36488/cmac.2024.2.141-147.
3. Клинические рекомендации Внебольничная пневмония у взрослых 2024г. https://cr.minzdrav.gov.ru/.
4. Villafuerte D., Aliberti S., Soni N.J., Faverio P., Marcos P.J., Wunderink R.G., Rodriguez A., Sibila O., Sanz F., Martin-Loeches I., Menzella F., Reyes L.F., Jankovic M., Spielmanns M., Restrepo M.I. GLIMP Investigators. Prevalence and risk factors for Enterobacteriaceae in patients hospitalized with community-acquired pneumonia. Respirology. 2020;25(5):543-551. doi: 10.1111/resp.13663.
5. Aston S.J., Wootton D.G. Community-acquired pneumonia due to drug-resistant Enterobacteriaceae: A global perspective. Respirology. 2020;25(5):468-469. doi: 10.1111/resp.13720.
6. Aliberti S, Dela Cruz CS, Amati F, Sotgiu G, Restrepo MI. Community-acquired pneumonia. Lancet. 202;398 (10303):906-919. doi: 10.1016/S0140-6736(21)00630-9.
7. Pusparajah P., Letchumanan V., Goh B.H., McGaw L.J. Editorial: Novel approaches to the treatment of multidrug-resistant bacteria, Volume II. Front Pharmacol. 2020;13:1090618. doi: 10.3389/fphar.2022.1090618.
8. Shen L., Wang L., Liu C., Shi S., Takahashi T., Wang T. Community-acquired pneumonia: Trends in and research on drug resistance and advances in new antibiotics. Biosci Trends. 2021;15(5): 266–275. doi: 10.5582/bst.2021.01342.
9. Nakagawa N., Katsurada M., Fukuda Y., Noguchi S., Horita N., Miki M., Tsukada H., Senda K., Shindo Y., Mukae H. Risk factors for drug-resistant pathogens in community-acquired pneumonia : systematic review and meta-analysis. Eur Respir Rev. 2025;34(175):240183. doi: 10.1183/16000617.0183–2024.
10. Liapikou A., Cilloniz C., Palomeque A., Torres T. Emerging antibiotics for community-acquired pneumonia. Expert Opin Emerg Drugs. 2019;24 (4):221–231. doi: 10.1080/14728214.2019.1685494.
11. Российские рекомендации «Определение чувствительности микроорганизмов к антимикробным препаратам» 2024 г. https://www.antibiotic.ru / library / ocmap2024/.
12. Magiorakos A.P., Srinivasan A., Carey R.B., Carmeli Y., Falagas M.E., Giske C.G., Harbarth S., Hindler J.F., Kahlmeter G., Olsson-Liljequist B., Paterson D.L., Rice L.B., Stelling J., Struelens M.J., Vatopoulos A., Weber J.T., Monnet D.L. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect. 2012;18(3):268-81. doi: 10.1111/j.1469-0691.2011.03570.x.
13. Елькина М.А., Яцышина С.Б., Тронза Т.В., Рачина С.А., Спичак Т.В., Акимкин В.Г. Эффективность молекулярно-генетических методов диагностики инфекций, вызванных S. pneumoniae и H. influenzae. Эпидемиология и инфекционные болезни. Актуальные вопросы. 2023;13 (2):56-62. doi: 10.18565/epidem.2023.13.2.56-62.
14. Цыганко Д. В., Бердникова Н. Г., Красных Л. М. и др. Некоторые клинико-фармакологические аспекты терапии внебольничной пневмонии. Эффективная фармакотерапия. 2019;15(27):28–36. Doi: 10.33978/2307-3586-2019-15-27-28-36.
15. Amati F., Bindo F., Stainer A., Gramegna A., Mantero M., Nigro M., Bussini L., Bartoletti M., Blasi F., Aliberti S. Identify Drug-Resistant Pathogens in Patients with Community-Acquired Pneumonia. Adv Respir Med. 2023;91(3):224-238. doi: 10.3390/arm91030018.
16. Белобородов В.Б., Голощапов О.В., Гусаров В.Г., Дехнич А.В., Замятин М.Н., Золотухин К.Н., Зубарева Н.А., Зырянов С.К., Камышова Д.А., Климко Н.Н., Козлов Р.С., Кулабухов В.В., Матинян Н.В., Петрушин М.А., Полушин Ю.С., Попов Д.А., Пырегов А.В., Руднов В.А., Сидоренко С.В., Соколов Д.В., Сычев И.Н., Шлык И.В., Эйдельштейн М.В., Яковлев С.В. Диагностика и антимикробная терапия инфекций, вызванных полирезистентными микроорганизмами» (обновление 2024 года). Вестник анестезиологии и реаниматологии. 2025;22(2):149-189. doi: 10.24884/2078-5658-2025-22-2-149-189..
17. Российские клинические рекомендации. Программа СКАТ (стратегия контроля антимикробной терапии) при оказании стационарной медицинской помощи 2018г. https://antimicrob.net/about/
18. Chen G., Xu K., Sun F., Sun Y., Kong Z., Fang B. Risk Factors of Multidrug-Resistant Bacteria in Lower Respiratory Tract Infections : A Systematic Review and Meta-Analysis. Can J Infect Dis Med Microbiol. 2020;2020:7268519. doi: 10.1155/2020/7268519.
19. Ukai T., Maruyama T., Tomioka S., Fukui T., Matsuda S., Fushimi K., Iso H. Predictors of hospital mortality and multidrug-resistant pathogens in hospitalized pneumonia patients residing in the community. Heliyon. 2023 Nov 15;9(12):e22303. doi: 10.1016/j.heliyon.2023.e22303.
20. Covington E.W., Rufe A. Identification of risk factors for multidrug-resistant organisms in community-acquired bacterial pneumonia at a community hospital. J Pharm Pract. 2023;36: 303–308. doi: 10.1177/08971900211039700.
21. Агеевец В.А., Агеевец И.В., Сидоренко С.В. Конвергенция множественной резистентности и гипервирулентности у Klebsiella pneumoniae. Инфекция и иммунитет. 2022;12(3): 22. 450-460. doi: 10.15789/2220-7619-COM-1825.
22. Barreto JV, Dias CC, Cardoso T. Risk factors for community-onset pneumonia caused by drug-resistant pathogens: A prospective cohort study. Eur J Intern Med. 2022;96:66-73. doi: 10.1016/j.ejim.2021.10.005.
23. Fally M., Hansel J., Robey R.C., Haseeb F., Kouta A., Williams T., Felton T., Mathioudakis A.G. Decoding community-acquired pneumonia : a systematic review and analysis of diagnostic criteria and definitions used in clinical trials. Clin Microbiol Infect. 2025;31(5):724-730. doi: 10.1016/j.cmi.2024.12.028.
24. Leo F, Stegemann M.S., Maurer F. Antibiotic Stewardship bei ambulant erworbener Pneumonie [Antibiotic Stewardship in Community-Acquired Pneumonia]. Dtsch Med Wochenschr. 2020;145(6):383-392. doi: 10.1055/a-0993-1164.
25. Эйдельштейн М.В., Шайдуллина Э.Р., Иванчик Н.В., Дехнич А.В., Микотина А.В., Склеенова Е.Ю., Сухорукова М.В., Азизов И.С., Шек Е.А., Романов А.В., Трушин И.С., Кузьменков А.Ю., Козлов Р.С. Антибиотикорезистентность клинических изолятов Klebsiella pneumoniae и Escherichia coli в стационарах России: результаты многоцентрового эпидемиологического исследования. Клиническая микробиология и антимикробная химиотерапия. 2024;26(1):67-78. doi: 10.36488/cmac.2024.1.67-78.
26. Sando E., Suzuki M., Ishida M., Yaegashi M., Aoshima M., Ariyoshi K., Morimoto K. Definitive and Indeterminate Pseudomonas aeruginosa Infection in Adults with Community-acquired Pneumonia: A Prospective Observational Study. Ann Am Thorac Soc. 2021;18(9):1475-1481. doi: 10.1513/AnnalsATS.201906-459OC.
Об авторах
О. П. БоброваРоссия
Ольга Петровна Боброва, д. м. н., доцент, доцент кафедры, зав. отделением, врач — клинический фармаколог
кафедра фармакологии и клинической фармакологии с курсом ПО; отделение клинической фармакологии
Красноярск
Конфликт интересов:
Автор декларирует отсутствие конфликта интересов
С. К. Зырянов
Россия
Сергей Кенсаринович Зырянов, д. м. н., профессор, зав. кафедрой, зам. главного врача по медицинской части (по терапии)
кафедра общей и клинической фармакологии
Москва
Конфликт интересов:
Автор декларирует отсутствие конфликта интересов
В. В. Черная
Россия
Вита Викторовна Черная, врач-бактериолог
Красноярск
Конфликт интересов:
Автор декларирует отсутствие конфликта интересов
М. В. Стаценко
Россия
Марина Викторовна Стаценко, и. о. зав. лабораторией, биолог
Красноярск
Конфликт интересов:
Автор декларирует отсутствие конфликта интересов
О. А. Парыгина
Россия
Ольга Александровна Парыгина, зав. лабораторией
ПЦР-лаборатория
Красноярск
Конфликт интересов:
Автор декларирует отсутствие конфликта интересов
Рецензия
Для цитирования:
Боброва О.П., Зырянов С.К., Черная В.В., Стаценко М.В., Парыгина О.А. Реализация микробиологического мониторинга для прогнозирования полирезистентного фенотипа респираторных изолятов на основе анализа факторов риска у пациентов с внебольничной пневмонией. Реальная клиническая практика: данные и доказательства. 2025;5(2):58-71. https://doi.org/10.37489/2782-3784-myrwd-074. EDN: FUCCBB
For citation:
Bobrova O.P., Zyryanov S.K., Chernaya V.V., Statsenko M.V., Parygina O.A. Implementation of microbiological monitoring for predicting the multidrug-resistant phenotype of respiratory isolates based on risk factor analysis in patients with community-acquired pneumonia. Real-World Data & Evidence. 2025;5(2):58-71. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-074. EDN: FUCCBB
JATS XML






























