Перейти к:
Биоплёнки метициллин-резистентных стафилококков и возможность борьбы с ними с помощью хлоргексидина и полигексанида: перспективы использования в реальной клинической практике
https://doi.org/10.37489/2782-3784-myrwd-075
EDN: NXKLWD
Аннотация
Введение. Ведущими возбудителями имплантат-ассоциированной инфекции являются S. aureus и S. epidermidis, характеризующиеся способностью формировать биоплёнки, представляющие серьёзную угрозу для жизни и здоровья пациентов. Антибиотикотерапия является неотъемлемой частью комплексного лечения инфекции, однако большую роль играет промывание области хирургического вмешательства после удаления инфицированных компонентов антисептиками, в том числе на основе растворов полигексанида или хлоргексидина.
Цель исследования. Оценить наличие генов биоплёнкообразования у метициллин-резистентных S. aureus и S. epidermidis, выделенных от пациентов с ортопедической инфекцией, а также выполнить сравнительный анализ действия хлоргексидина и полигексанида на их биоплёнки.
Материалы и методы. Выделение культур выполняли в соответствии с международными стандартами микробиологических исследований. Идентификацию выполняли методом MALDI-TOF MS, антибиотикочувствительность определяли в соответствии с EUCAST. Выделение и очистку ДНК проводили с использованием Auto-Pure S32 и набора Магно-Сорб. Амплификацию осуществляли на приборе CFX-96. Визуализацию выполняли системой гель-документации ChemiDoc. Биоплёнки формировали 48 часов, а затем обрабатывали полигексанидом или хлор-гексидином в течение 5, 10, 20, 40 минут. Деструктивное действие антисептиков определяли путём окраски генцианвиолетом и последующим сравнением с контролем. Наличие живых бактериальных клеток в биоплёнке после обработки препаратами оценивали с помощью раствора резазурина. Статистический анализ выполняли в GraphPad Prism 9.0.
Результаты. Выявлен ген bap и не обнаружено генов ica-оперона. MRSA характеризовались наличием 3-х маркерных генов, а штаммы MRSE имели один или два маркерных гена. Полигексанид более эффективно разрушал биомассу сформированных суточных биоплёнок S. aureus — носителей генов bap, clfA/B, в отличие от хлоргексидина. Полигексанид статистически значимо снижал биомассу при экспозиции более 10 минут. Аналогичная закономерность выявлена и в отношении биоплёнок MRSE. Кроме того, препараты практически полностью уничтожали сесильные формы MRSE, а для бесплёночных клеток MRSA более эффективным был
полигексанид.
Заключение. Выполненное исследование позволило выявить основные генетические детерминанты биоплёнкообразования у метициллин-резистентных S. aureus и S. epidermidis. Установленные межвидовые генетические различия могут определять эффективность антисептиков и демонстрируют необходимость экспозиции изученных антисептических препаратов не менее 20 минут для достижения максимального действия на сесильные клетки стафилококков.
Для цитирования:
Гордина Е.М., Шахматова А.Д., Касимова А.Р., Торопов С.С., Божкова С.А. Биоплёнки метициллин-резистентных стафилококков и возможность борьбы с ними с помощью хлоргексидина и полигексанида: перспективы использования в реальной клинической практике. Реальная клиническая практика: данные и доказательства. 2025;5(2):72-82. https://doi.org/10.37489/2782-3784-myrwd-075. EDN: NXKLWD
For citation:
Gordina E.M., Shakhmatova A.D., Kasimova A.R., Toropov S.S., Bozhkova S.A. Methicillin-resistant staphylococci biofilms and the possibility of controlling them with chlorhexidine and polyhexanide: prospects for use in real clinical practice. Real-World Data & Evidence. 2025;5(2):72-82. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-075. EDN: NXKLWD
Введение / Introduction
Инфекции, связанные с образованием биоплёнок, являются существенным фактором, способствующим развитию хронических рецидивирующих заболеваний из-за устойчивости сесильных бактерий к антибиотикам, иммунной системе хозяина и другим внешним раздражителям. В травматологии и ортопедии с образованием биоплёнок связаны в первую очередь случаи развития имплантат-ассоциированной инфекции (ИАИ), так как большинство видов хирургического лечения нарушений опорно-двигательного аппарата требуют установки имплантатов (спиц, пластин, винтов, штифтов, эндопротезов и т. д.). Количество подобных операций растёт с каждым годом, в связи с общим старением населения, стремлением пациентов к высокому качеству жизни, увеличением доступности высокотехнологичных видов медицинской помощи и появлением новых методов лечения. Частота развития ИАИ варьируется от 2,5 % после первичной установки имплантата до 20 % при повторных ревизионных операциях [1].
Ведущими возбудителями ИАИ в травматологии и ортопедии по-прежнему остаются Staphylococcus aureus и Staphylococcus epidermidis. По данным научных публикаций частота выделения отдельных видов варьирует, но лидирующие позиции Staphylococcus spр. как этиологического агента ИАИ неоспорима. По нашим данным на протяжении 12 лет наблюдения с 2011 по 2022 гг. на первом месте по частоте выделения оставался S. aureus — 31,3 %, а на втором S. epidermidis — 18,6 % [2]. Об аналогичных результатах сообщают и другие исследователи, меняется только соотношение видов. Так в исследовании Любимовой и соавт. ведущим возбудителем ИАИ являлись S. еpidermidis (29,7 %) с преобладанием метициллин-резистентных штаммов — 24 %, на втором месте определяли S. aureus — 23 % [3]. Аналогичные результаты опубликованы в исследовании Fröschen F. S. и соавт. — наиболее частым возбудителем ортопедической ИАИ были коагулазонегативные стафилококки (чаще S. epidermidis), на долю которых пришлось около 45 %, на втором месте по частоте выделения стабильно регистрировали S. aureus — 14 % [4].
Стафилококки характеризуются способностью формировать биоплёнки на различных искусственных поверхностях и окружающих их тканях, которые представляют собой фиксированные микробные сообщества, заключённые во внеклеточные полимерные вещества, продуцируемые бактериями [5]. Основными генами стафилококков, регулирующими биоплёнкообразование, являются bap, icaABCD, icaR, fnbA/B, clfA/B [6]. Биоплёнки характеризуются необратимой адгезией микробных клеток к различным поверхностям или друг к другу, а также канальной структурой, регулирующей и осуществляющей высвобождение питательных веществ и антимикробных препаратов [7]. Биоплёнки, связанные с медицинскими имплантатами, представляют серьёзную угрозу для жизни и здоровья пациентов и создают дополнительную финансовую нагрузку на систему здравоохранения.
Системная антибиотикотерапия является неотъемлемой частью комплексного лечения инфекции, ассоциированной с ортопедическими имплантатами. Однако большую роль в обеспечении радикальности при хирургической обработке гнойного очага играет промывание области хирургического вмешательства после удаления инфицированных компонентов антисептиками, в том числе на основе растворов полигексанида или хлоргексидина [8].
Цель исследования / Objective
Оценить наличие генов биоплёнкообразования у метициллин-резистентных S. aureus и S. epidermidis, выделенных от пациентов с ортопедической инфекцией, а также выполнить сравнительный анализ действия хлоргексидина и полигексанида на их биоплёнки.
Материалы и методы / Materials and methods
Выделение клинических изолятов S. aureus (n=4) и S. epidermidis (n=4) выполняли в соответствии с международными стандартами микробиологических исследований. Видовую идентификацию выполняли методом MALDI-TOF MS с использованием системы FlexControl и программного обеспечения MBT Compass 4.1., Score ≥ 2,0. Чувствительность к антибактериальным препаратам определяли в соответствии с EUCAST (2025, v. 15.0). В исследование включены штаммы S. aureus и S. epidermidis, устойчивые к цефокситину (зона подавления роста вокруг диска с цефокситином менее 22 мм и 27 мм соответственно), выделенные проспективно от пациентов с ортопедической инфекцией в 2025 г. Номер штамма соответствует его идентификационному номеру в системе ЛИС «Акросс-Инжири».
Молекулярно-генетические методы. Для выделения геномной ДНК проводили дополнительный лизис бактериальных клеток в присутствии 20 мг/мл лизостафина (Sigma Aldrich, USA) и 50 мг/мл лизоцима (Amresco, USA) в трис-ЭДТА буфере в течение 60 минут при 37ºС. Дальнейшее выделение и очистку ДНК проводили с использованием системы автоматического выделения нуклеиновых кислот Auto-Pure S32 (Allsheng, Китай) и коммерческого набора Магно-Сорб (Амплисенс, Россия) в соответствии с протоколом производителя. Амплификацию осуществляли на приборе CFX-96 (BioRad, США) с использованием коммерческого набора БиоМастер HS-qPCR SYBR Blue (2X) (Биолабмикс, Россия). Визуализацию продуктов ПЦР осуществляли в 1 % агарозном геле системой гель-документации ChemiDoc MP Imaging System (BioRad, США). Синтез олигонуклеотидов осуществлялся компанией Евроген (Россия). Олигонуклеотидные праймеры, протоколы проведения ПЦР представлены в таблице 1.
Оценка влияния антисептиков на сформированные биоплёнки. Все тестируемые штаммы метициллин-резистентных штаммов S. aureus (MRSA) и S. epidermidis (MRSE) характеризовались способностью образовывать биоплёнки и чувствительностью к тестируемым антисептикам. Биоплёнки формировали в полистироловых 96-луночных плоскодонных планшетах. Для этого в лунки планшета вносили 180 мкл стерильного бульона LB с 1 % глюкозы и 20 мкл взвеси суточной культуры стафилококков (0,5 по шкале МакФарланда). Через двое суток промытые, высушенные лунки обрабатывали 200 мкл 0,1 % раствора полигексанида или 0,05 % раствором хлоргексидина в течение 5 минут, 10 минут, 20 минут, 40 минут. Контрольные лунки обрабатывали физиологическим раствором. Деструктивное действие антисептиков определяли путём окраски сформированных и промытых после антисептиков биоплёнок 0,1 % раствором генцианвиолета и последующим сравнением с контролем. Суммарную биомассу сформированных плёнок оценивали по оптической плотности (ОП) полученных спиртовых экстрактов связавшегося красителя при 570 нм на спектрофотометре «Spectrostar Nano». Статистически значимое снижение ОП экстрактов красителя опытных лунок в сравнении с ОП контрольных лунок считали достаточным временем для разрешения биомассы микробной плёнки.
Таблица 1. Параметры ПЦР-реакции Table 1. PCR reaction parameters | |||
Ген | Последовательность праймеров 5’→3’ | Параметры ПЦР | Размер ампликона, н. п. |
bap | Прямой праймер: CCCTATATCGAAGGTGTAGAATTGCAC Обратный праймер: GCTGTTGAAGTTAATACTGTACCTGC | 95°С — 3 минуты,40 циклов: 95°С — 30 секунд; 52° — 30 секунд; 72° — 60 секунд Финальная элонгация: 72°С — 5 минут | 971 |
icaAD | Прямой праймер: TATTCAATTTACAGTCGCAC Обратный праймер: GATTCTCTCCCTCTCTGCCA | 95°С — 3 минуты,35 циклов: 95°С — 30 секунд; 52° — 30 секунд; 72° — 60 секунд Финальная элонгация: 72°С — 5 минут | 407 |
icaBC | Прямой праймер: GCCTATCCTTATGGCTTGA Обратный праймер: TGGAATCCGTCCCATCTC | 95°С — 3 минуты,35 циклов: 95°С — 30 секунд; 52° — 30 секунд; 72° — 60 секунд Финальная элонгация: 72°С — 5 минут | 182 |
icaR | Прямой праймер: TACTGTCCTCAATAATCCCGAA Обратный праймер: GGTACGATGGTACTACACTTGATG | 95°С — 15 минут,35 циклов: 95°С — 40 секунд; 53° — 50 секунд; 72° — 5 секунд Финальная элонгация: 72°С — 10 минут | 453 |
fnbA | Прямой праймер: CACAACCAGCAAATATAG Обратный праймер: CTGTGTGGTAATCAATGTC | 95°С — 5 минут,35 циклов: 94°С — 45 секунд; 55° — 60 секунд; 72° — 50 секунд Финальная элонгация: 72°С — 4 минуты | 1362 |
fnbB | Прямой праймер: GGAGAAGGAATTAAGGCG Обратный праймер: GCCGTCGCCTTGAGCGT | 95°С — 5 минут,35 циклов: 95°С — 15 секунд; 56° — 60 секунд; 72° — 60 секунд Финальная элонгация: 72°С — 3 минуты | 813 |
clfA | Прямой праймер: GTAGGTACGTTAATCGGTT Обратный праймер: CTCATCAGGTTGTTCAGG | 95°С — 5 минут,35 циклов: 95°С — 45 секунд; 56°С — 60 секунд; 72° — 60 секунд Финальная элонгация: 72°С — 3 минуты | 1584 |
clfB | Прямой праймер: TGCAAGATCAAACTGTTCCT Обратный праймер: TCGGTCTGTAAATAAAGGTA | 95°С — 5 минут,35 циклов: 95°С — 45 секунд; 57° — 60 секунд; 72° — 55 секунд Финальная элонгация: 72°С — 5 минуты | 596 |
Оценка влияния антисептиков на сесильные бактерии в составе биоплёнок. После промывки в каждую лунку планшета с биоплёнкой добавляли 190 мкл среды LB и 10 мкл водного раствора резазурина (Eugen). Микропланшеты инкубировали в течение 2 часов в темноте при 37°С. Изменение цвета с синего на розовый указывает на восстановление резазурина живыми бактериальными клетками. Эффективной считали длительность экспозиции антисептика, при которой не регистрировали изменение окраски резазурина, подтверждающее угнетение метаболической активности бактерий.
Статистический анализ полученных результатов выполняли с помощью программы GraphPad Prism 9.0 (США) с использованием t-теста. Значения p<0.05 считали статистически значимыми.
Результаты / Results
У всех клинических изолятов MRSA и MRSE выявлен ген bap (табл. 1) и не обнаружено генов ica-оперона (icaAD и icaBC). Из восьми исследованных культур ген fnbA регистрировали только у двух штаммов MRSE.
Изоляты MRSA характеризовались наличием 3-х маркерных генов, а штаммы MRSE имели один или два маркерных гена. Визуализированы продукты амплификации маркерных генов MRSE 2641 и MRSA 6604 (Рис. 1).
Таблица 2. Гены биоплёнкообразования клинических штаммов стафилококков Table 2. Biofilm formation genes of clinical strains of staphylococci | ||||||||
Ген Изолят | bap | icaAD | icaBC | icaR | fnbA | fnbB | clfA | clfB |
MRSA | ||||||||
7095 | + | - | - | + | - | - | + | + |
4095 | + | - | - | - | - | - | + | + |
6604 | + | - | - | - | - | - | + | + |
6611 | + | - | - | - | - | - | + | + |
MRSE | ||||||||
6759 | + | - | - | - | - | - | - | - |
5039 | + | - | - | - | + | - | - | - |
2681 | + | - | - | - | + | - | - | - |
2641 | + | - | - | - | - | - | - | - |
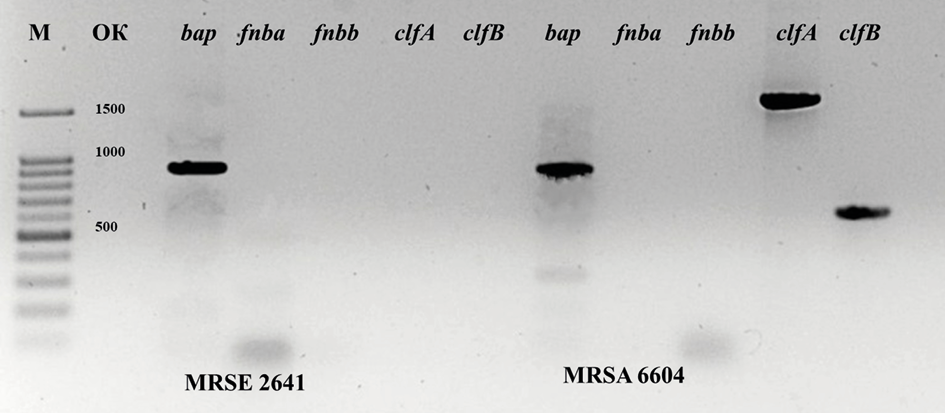
Рис. 1. Электрофореграмма продуктов амплификации
Fig. 1. Electropherogram of amplification products
Примечания: М — маркер длин ДНК 100+bp; ОК — отрицательный контрольный образец.
Notes: M–DNA length marker 100+bp; OK — negative control sample.
Сравнительная оценка влияния антисептиков на биоплёнки метициллин-резистентных стафилококков показала, что полигексанид более эффективно разрушал биомассу сформированных суточных биоплёнок MRSA — носителей генов bap, clfA и clfB, в отличие от хлоргексидина (рис. 2). Полигексанид статистически значимо снижал биомассу при экспозиции более 10 минут.
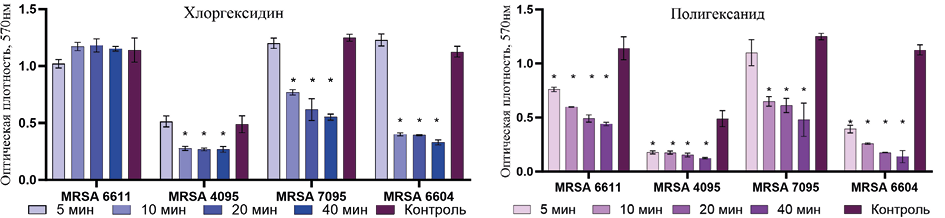
Рис. 2. Биомасса биоплёнок метициллин-резистентных S. aureus после экспозиции различной длительности с тестируемыми антисептиками
Fig. 2. Biomass of methicillin-resistant S. aureus biofilms after exposure of varying duration to the tested antiseptics
Примечание: * — p <0,05.
Note: * — p <0.05.
Аналогичная закономерность выявлена и при сравнительной оценке влияния хлоргексидина и полигексанида в отношении биоплёнок метициллин-резистентных S. epidermidis (рис. 3). Уже через 5 минут экспозиции с полигексанидом регистрировали статистически значимое снижение биомассы плёнки. В свою очередь хлоргексидин демонстрировал эффективность в отношении биоплёнок двух тестируемых штаммов после 10 мин выдержки, а на биоплёнку штамма MRSE 2641 практически не влиял.
Изучение влияния антисептиков на сесильные бактериальные клетки показало, что тестируемые препараты практически полностью уничтожали биоплёночные формы метициллин-резистентных S. epidermidis (табл. 3).
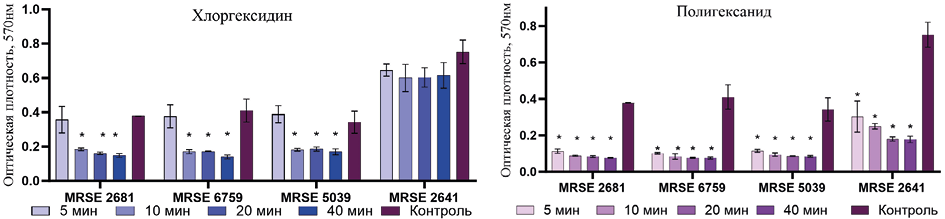
Рис. 3. Биомасса биоплёнок метициллин-резистентных S. epidermidis после экспозиции различной длительности с тестируемыми антисептиками
Fig. 3. Biomass of methicillin-resistant S. epidermidis biofilms after exposure of varying duration to the tested antiseptics
Примечание: * — p <0,05.
Note: * — p <0.05.
В отношении сесильных клеток MRSA более эффективным был полигексанид, однако эти различия были минимальны в рамках данной выборки штаммов. Такие различия в действие антисептиков на бактерии в составе биоплёнки могут быть связаны с наличием различными генов, отвечающих за биоплёнкообразование и, как следствие, различным составом матрикса, продуцируемого бактериями разных видов стафилококков.
Таблица 3. Метаболическая активность сесильных MRSA и MRSE в присутствии резазурина после обработки лунок антисептиками в течение 5, 10, 20 и 40 минут Table 3. Metabolic activity of MRSA and MRSE in the presence of resazurin after treatment of wells with antiseptics for 5, 10, 20 and 40 minutes | |||||||
Антисептик | № штамма | 5 мин | 10 мин | 20 мин | 40 мин | К+ | К - |
MRSA | |||||||
0,05 % раствором хлоргексидина | 6611 | 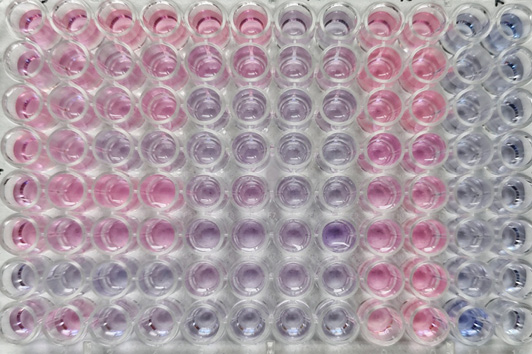 | |||||
4095 | |||||||
7095 | |||||||
6604 | |||||||
0,1 % раствор полигексанида | 6611 | ||||||
4095 | |||||||
7095 | |||||||
6604 | |||||||
MRSE | |||||||
0,05 % раствором хлоргексидина | 2681 | 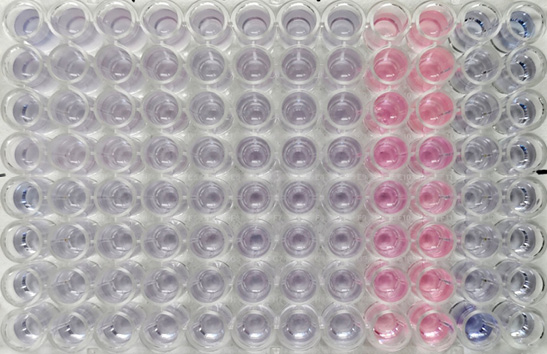 | |||||
6759 | |||||||
5039 | |||||||
2641 | |||||||
0,1 % раствор полигексанида | 2681 | ||||||
6759 | |||||||
5039 | |||||||
2641 | |||||||
Обсуждение / Discussion
Примерно 80 % хронических инфекционных заболеваний человека связаны с существованием возбудителей в составе биоплёнок, что подчёркивает их значительное влияние на здоровье населения и систему здравоохранения [7]. Ген bap (biofilm-associated protein) кодирует продукцию высокомолекулярного поверхностного белка — альтернативный icaADBC-зависимому пути образования биоплёнок. Несмотря на то, что некоторые исследователи считают, что его распространённость у клинических изолятов S. aureus (включая MRSA) крайне низка [9], в нашем исследовании ген bap был обнаружен у всех клинических изолятов обоих видов. Кроме того, все штаммы MRSA характеризовались наличием генов clfA и clfB, что указывает на преобладание белкового компонента матрикса их биоплёнок. Напротив, в исследовании Ярец Ю. И. и соавт. у 87,5 % изолятов S. aureus, полученных из раневого отделяемого пациентов, выявили гены оперона ica (icaAD и icaBC), что свидетельствует о полисахаридном составе матрикса, при этом icaR не был обнаружен ни у одного из изолятов [10]. У изученных нами штаммов не установлено наличие генов, связанных с ica-опероном, что нехарактерно для MRSA и MRSE, однако штамм MRSA 7095 имел ген icaR, что может указывать на утрату всего оперона. При этом все включённые в настоящее исследование штаммы характеризовались наличием способности формировать биоплёнку.
Известно, что вещества, обладающие антибиоплёночным действием, могут оказывать влияние на различные этапы процесса формирования микробной биоплёнки и на метаболически различные фенотипы бактерии в её составе. Активные соединения могут ингибировать образование биоплёнки препятствуя бактериальной адгезии или разрушать матрикс уже сформированной биоплёнки, делая микробные клетки чувствительными к действию антибиотиков [5].
Применение хлоргексидина в медицинских учреждениях возросло за эти годы благодаря исследованиям, демонстрирующим возможные преимущества его использования для профилактики развития и лечения раневых инфекций [11]. Установлено, что хлоргексидин более активен против грамположительных бактерий, он разрушает клеточную стенку бактерий, влияя на осмотическое равновесие клетки [11]. Данный антисептик характеризуется хорошей цитосовместимостью, однако возможно развитие редких местных нежелательных реакции на его применение [12]. Вследствие широкого применения хлоргексидина растёт количество устойчивых к нему штаммов. Кроме того, в одном исследовании показана возможность развития перекрёстной устойчивости патогенов к антибиотикам [12]. В другом — авторы не обнаружили доказательств снижения фенотипической восприимчивости бактериальных изолятов к хлоргексидину через 12 мес. после его внедрения в рутинную антисептическую обработку фомитов и поверхностей [13]. Brown JL с соавт. показали, что хлоргексидин оказывал выраженное антибиоплёночное действие [14].
Полигексанид характеризуется широкой антибактериальной активностью и хорошей переносимостью тканями [15]. В исследовании Paleczny J. было показано, что для лечения ран полигексанид является средством выбора из-за его высокой эффективности против биоплёнок патогенов [16].
В своей работе мы выявили различную направленность действия антисептиков на основе полигексанида и хлоргексидина в отношении метициллин-резистентных стафилококков, выделенных от пациентов с ортопедической инфекцией. Препарат на основе полигексанида показал более эффективное разрушение биомассы сформированных 48-часовых биоплёнок, в сравнении с хлоргексидином. В свою очередь Santos DSF с соавт. выполнили сравнительную оценку антимикробного действия растворов полигексанида и хлоргексидина в отношении возбудителей стоматологических инфекций и указали на более высокую активность полигексанида, в сравнении с хлоргексидином [17].
По данным научной литературы, матрикс биоплёнок стафилококков состоит из полисахаридов, белков, тейхоевых кислот и экстрацеллюлярной ДНК [18]. В зависимости от состава матрикса стафилококковые биоплёнки можно разделить на две категории: биоплёнки, состоящие из полисахаридного матрикса (PIA-зависимый тип биоплёнкообразования), и биоплёнки с белковым матриксом (PIA-независимый тип биоплёнкообразования) [18]. Биоплёнки с преобладанием полисахаридных компонентов чаще образуют S. epidermidis, с белковым матриксом — S. aureus. [18]. В нашем исследовании изученные клинические штаммы метициллин-резистентных S. aureus и S. epidermidis характеризовались наличием генов, характерных для PIA-независимого пути биоплёнкообразования и указывающих на преобладание белковых компонентов матрикса их биоплёнок.
В исследовании Yi Xue с соавт. была обнаружена корреляция между чувствительностью к хлоргексидину и наличием гена bap у Staphylococcus spp. авторы установили, что наличие bap у коагулазонегативных стафилококков может свидетельствовать о низкой эффективности хлоргексидина, так как носители данного гена демонстрируют толерантность к высоким дозам антисептиков, за счёт более быстрого формировании биоплёнки [19]. Это согласуется с полученными нами результатами: все протестированные клинические штаммы MRSA и MRSE несли ген bap и при этом хлоргексидин оказывал меньшее влияние на сформированные биоплёнки, в сравнении с полигексанидом.
Оба изученных антисептических препарата в равной степени демонстрировали выраженное антибактериальное действие против сесильных клеток MRSE в составе 48-часовых биоплёнок, однако в отношении клеток MRSA регистрировали практически полную их неэффективность при экспозициях менее 40 минут. Выявленные могут быть связаны с генетически обусловленными отличиями архитектуры построения биоплёнки разными видами стафилококков, что ограничивает проникновение препарата внутрь биоплёнки.
Заключение / Conclusion
Выполненное исследование позволило выявить основные генетические детерминанты, отвечающие за процесс биоплёнкообразования у метициллин-резистентных штаммов S. aureus и S. epidermidis, выделенных от пациентов ортопедического профиля. Установленные межвидовые генетические различия могут определять эффективность антисептиков в отношении бактериальных клеток в составе зрелых биоплёнок. Полученные результаты демонстрируют необходимость экспозиции при клиническом применении изученных антисептических препаратов не менее 20 минут для достижения максимального действия на сесильные клетки стафилококков. Дальнейшие исследования должны быть сосредоточены на оптимизации времени воздействия антисептического препарата и разработке улучшенных стратегий промывания области хирургического вмешательства, обеспечивающих достаточное антибактериальное действие и хорошую цитосовместимость препарата в клинической практике для безопасного применения.
Список литературы
1. Samelis P, Papagrigorakis E, Sameli E, Mavrogenis A, Savvidou O, Koulouvaris P. Current concepts on the application, pharmacokinetics and complications of antibiotic loaded cement spacers in the treatment of prosthetic joint infections. Cureus. 2022;14(1):e20968. doi: 10.7759/cureus.20968.
2. Касимова А.Р., Туфанова О.С., Гордина Е.М., Гвоздецкий А.Н., Радаева К.С., Рукина А.Н., Божкова С.А., Тихилов Р.М. Двенадцатилетняя динамика спектра ведущих возбудителей ортопедической инфекции : ретроспективное исследование. Травматология и ортопедия России. 2024;30(1):6675. doi: 10.17816/2311290516720.
3. Любимова Л.В., Пчелова Н.Н., Николаев Н.С., Преображенская Е.В., Любимов Е. А. Микробиологический профиль пациентов с ортопедической имплантат-ассоциированной инфекцией в постковидном периоде. Acta Biomedica Scientifica. 2024;9(3):203-212. doi: 10.29413/ABS.2024-9.3.20.
4. Fröschen FS, Randau TM, Franz A, Molitor E, Hischebeth GTR. Microbiological profiles of patients with periprosthetic joint infection of the hip or knee. Diagnostics (Basel). 2022; 12(7): 1654. doi: 10.3390/diagnostics12071654
5. François P, Schrenzel J, Götz F. Biology and Regulation of Staphylococcal Biofilm. Int J Mol Sci. 2023;24(6):5218. doi: 10.3390/ijms24065218.
6. Peng Q, Tang X, Dong W, Sun N, Yuan W. A Review of Biofilm Formation of Staphylococcus aureus and Its Regulation Mechanism. Antibiotics (Basel). 2022;12(1):12. doi: 10.3390/antibiotics12010012.
7. Almatroudi A. Biofilm Resilience: Molecular Mechanisms Driving Antibiotic Resistance in Clinical Contexts. Biology (Basel). 2025;14(2):165. doi: 10.3390/biology14020165.
8. Dudek B, Brożyna M, Karoluk M, Frankiewicz M, Migdał P, Szustakiewicz K, Matys T, Wiater A, Junka A. In Vitro and In Vivo Translational Insights into the Intraoperative Use of Antiseptics and Lavage Solutions Against Microorganisms Causing Orthopedic Infections. Int J Mol Sci. 2024;25(23):12720. doi: 10.3390/ijms252312720.
9. Tuchscherr L, Löffler B, Proctor RA. Persistence of Staphylococcus aureus: Multiple Metabolic Pathways Impact the Expression of Virulence Factors in Small-Colony Variants (SCVs). Front Microbiol. 2020;11:1028. doi: 10.3389/fmicb.2020.01028.
10. Ярец Ю.И., Шевченко Н.И., Мартинков В.Н. Биологические свойства Stаphylococcus aureus — продуцентов биоплёнки, выделенных из раневого отделяемого пациентов. Медико-биологические проблемы жизнедеятельности. 2021;(2):134-143.
11. Horner C, Mawer D, Wilcox M. Reduced susceptibility to chlorhexidine in staphylococci: is it increasing and does it matter? J Antimicrob Chemother. 2012 Nov;67(11):2547-59. doi: 10.1093/jac/dks284.
12. Van den Poel B, Saegeman V, Schuermans A. Increasing usage of chlorhexidine in health care settings: blessing or curse? A narrative review of the risk of chlorhexidine resistance and the implications for infection prevention and control. Eur J Clin Microbiol Infect Dis. 2022;41(3):349-362. doi: 10.1007/s10096-022-04403-w.
13. Denkel LA, Kramer TS, Schwab F, Golembus J, Wolke S, Gastmeier P, Geffers C. Chlorhexidine and octenidine susceptibility of bacterial isolates from clinical samples in a three-armed cluster randomised decolonisation trial. PLoS One. 2022;17 (12):e0278569. doi: 10.1371/journal.pone.0278569.
14. Brown JL, Townsend E, Short RD, Williams C, Woodall C, Nile CJ, Ramage G. Assessing the inflammatory response to in vitro polymicrobial wound biofilms in a skin epidermis model. NPJ Biofilms Microbiomes. 2022;8(1):19. doi: 10.1038/s41522-022-00286-z.
15. Brill FHH, Hambach J, Utpatel C, Mogrovejo DC, Gabriel H, Klock JH, Steinmann J, Arndt A. Biofilm reduction potential of 0.02 % polyhexanide irrigation solution in several types of urethral catheters. BMC Urol. 2021;21(1):58. doi: 10.1186/s12894-021-00826-3.
16. Paleczny J, Junka AF, Krzyżek P, Czajkowska J, Kramer A, Benkhai H, Żyfka-Zagrodzińska E, Bartoszewicz M. Comparison of antibiofilm activity of low-concentrated hypochlorites vs polyhexanide-containing antiseptic. Front Cell Infect Microbiol. 2023;13:1119188. doi: 10.3389/fcimb.2023.1119188.
17. Santos DSF, Peralta-Mamani M, Brandão FS, Andrade FB, Cruvinel T, Santos PSDS. Could polyhexanide and chlorine dioxide be used as an alternative to chlorhexidine? A systematic review. Sao Paulo Med J. 2022;140(1):42-55. doi: 10.1590/1516-3180.2020.0776.R1.18052021.
18. Uruén C, Chopo-Escuin G, Tommassen J, Mainar-Jaime RC, Arenas J. Biofilms as Promoters of Bacterial Antibiotic Resistance and Tolerance. Antibiotics (Basel). 2020;10(1):3. doi: 10.3390/antibiotics10010003.
19. Xue Yi, Lo D, Chang Ch, Huang M, Chien W, Lei Ya, Su Ya, Hsu P, Lai J. Effects of the bap and eno genes on the effectiveness of disinfectants against coagulase-negative staphylococci. Thaiwan Veterinary Journal. 2020;46(3):56-65. doi: 10.1142/S1682648520500055.
Об авторах
Е. М. ГординаРоссия
Екатерина Михайловна Гордина, к. м. н., старший научный сотрудник
отделение профилактики и лечения раневой инфекции
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов, связанных с публикацией настоящей статьи
А. Д. Шахматова
Россия
Александра Дмитриевна Шахматова, биолог
отделение клинической фармакологии
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов, связанных с публикацией настоящей статьи
А. Р. Касимова
Россия
Алина Рашидовна Касимова, к. м. н., доцент, доцент кафедры, врач – клинический фармаколог
кафедра клинической фармакологии и доказательной медицины; отделение клинической фармакологии
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов, связанных с публикацией настоящей статьи
С. С. Торопов
Россия
Сергей Сергеевич Торопов, врач – хирург-травматолог
отделение гнойной остеологии
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов, связанных с публикацией настоящей статьи
С. А. Божкова
Россия
Светлана Анатольевна Божкова, д. м. н., профессор, зав. отделением, профессор кафедры
научное отделение профилактики и лечения раневой инфекции; отделение клинической фармакологии; кафедра травматологии и ортопедии
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов, связанных с публикацией настоящей статьи
Рецензия
Для цитирования:
Гордина Е.М., Шахматова А.Д., Касимова А.Р., Торопов С.С., Божкова С.А. Биоплёнки метициллин-резистентных стафилококков и возможность борьбы с ними с помощью хлоргексидина и полигексанида: перспективы использования в реальной клинической практике. Реальная клиническая практика: данные и доказательства. 2025;5(2):72-82. https://doi.org/10.37489/2782-3784-myrwd-075. EDN: NXKLWD
For citation:
Gordina E.M., Shakhmatova A.D., Kasimova A.R., Toropov S.S., Bozhkova S.A. Methicillin-resistant staphylococci biofilms and the possibility of controlling them with chlorhexidine and polyhexanide: prospects for use in real clinical practice. Real-World Data & Evidence. 2025;5(2):72-82. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-075. EDN: NXKLWD
JATS XML






























