Перейти к:
Аналитический доклад Международного совета по гармонизации «Международная гармонизация терминологии доказательств, основанных на данных реальной клинической практики, и согласование общих принципов планирования и представления результатов исследований с использованием данных реальной клинической практики с акцентом на эффективность лекарств»
https://doi.org/10.37489/2782-3784-myrwd-38
EDN: EQMSZF
Аннотация
Данные реальной клинической практики и доказательства, получаемые на основе данных реальной клинической практики, играют всё более важную роль в разработке лекарственных средств и при принятии решений в здравоохранении. Для эффективного использования данных и получения надёжных доказательств они должны быть чётко определены и структурированы, должны быть семантически совместимы и согласованы между заинтересованными сторонами. 30 июня 2023 года Международный совет по гармонизации технических требований к лекарствам для медицинского применения (International Council on Harmonisation Technical Requirements for Pharmaceuticals; ICH) представил на обсуждение аналитический доклад «Международная гармонизация терминологии доказательств, основанных на данных реальной клинической практики, и Согласование общих принципов планирования и представления результатов исследований с использованием данных реальной клинической практики с акцентом на эффективность лекарств», в котором излагается их подход, направленный на обеспечение международной интеграции в этой сфере. В данной статье представлен обзор ключевых аспектов предложенного ICH стратегического плана.
Ключевые слова
Для цитирования:
Радаева К.С., Ниязов Р.Р. Аналитический доклад Международного совета по гармонизации «Международная гармонизация терминологии доказательств, основанных на данных реальной клинической практики, и согласование общих принципов планирования и представления результатов исследований с использованием данных реальной клинической практики с акцентом на эффективность лекарств». Реальная клиническая практика: данные и доказательства. 2023;3(3):20-27. https://doi.org/10.37489/2782-3784-myrwd-38. EDN: EQMSZF
For citation:
Radaeva K.S., Niyazov R.R. ICH Reflection paper on proposed international harmonization of real-world evidence terminology and convergence of general principles regarding planning and reporting of studies using real-world data, with a focus on effectiveness of drugs. Real-World Data & Evidence. 2023;3(3):20-27. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-38. EDN: EQMSZF
Введение
Возросший интерес к данным реальной клинической практики (РКП) и доказательствам, получаемым на основе данных реальной клинической практики, в поддержке принятия решений и оценке лекарственных средств и технологий здравоохранений на различных этапах разработки подчеркивает перед научным сообществом необходимость в стандартизации и согласовании на глобальном уровне терминологии и стратегических подходов, с целью облегчения и обеспечения международного сотрудничества.
Международная коалиция регуляторных органов в области лекарственных средств (англ. International Coalition of Medicines Regulatory Authorities; ICMRA) в 2022 году заявила о своей поддержке укрепления международного сотрудничества в области деятельности, направленной на использование доказательств, основанных на данных реальной клинической практики, при принятии регуляторных решений. В заявлении отмечается, что регуляторы по всему миру должны участвовать в устранении проблем, связанных с отсутствием стандартизации терминологии и форматов данных РКП и доказательств, основанных на данных РКП, неоднородностью качества данных в источниках данных РКП, а также различными дизайнами исследований, используемых в зависимости от типов заболеваний, лекарственных средств и регуляторного контекста. Решение этих проблем должно базироваться на общих определениях и лучших методах.
В аналитическом докладе Международный совет по гармонизации технических требований к лекарствам для медицинского применения (англ. International Council on Harmonisation Technical Requirements for Pharmaceuticals; ICH) излагается стратегический подход к решению некоторых из этих проблем. Цель доклада состоит в том, чтобы обеспечить дальнейшую интеграцию доказательств, основанных на данных РКП, в регуляторные документы для своевременного принятия решений.
Основные технические вопросы, требующие решения
Признавая, что традиционные рандомизированные клинические исследования (РКИ) являются основой для получения существенного доказательства безопасности и эффективности до получения разрешения на продажу; при соответствующих обстоятельствах другие подходы также могут обеспечивать получение доказательств, пригодных для принятия решений регуляторными органами. Например, доказательства, получаемые на основе данных РКП, могут быть получены с помощью данных РКП для определения конечных точек в РКИ или в качестве группы сравнения в исследованиях с внешним контролем (включая исследования с историческим контролем). Данные РКП также используются в неинтервенционных исследованиях, например для анализа использования одобренного лекарственного препарата в реальной клинической практике, а также для получения доказательств, подтверждающих решения регуляторных органов в отношении (долгосрочной) пострегистрационной безопасности и эффективности новых лекарственных средств. Данные РКП могут использоваться для лучшего понимания существующих схем лечения, сопутствующих заболеваний и прогноза развития болезни.
Тем не менее существует ряд проблем, включая неоднородность источников данных РКП (например, электронные медицинские карты, регистрационные данные, информация о претензиях, долгосрочные рецепты на лекарственные препараты, данные о выдаче или использовании других лекарственных препаратов, исходы, сообщаемые пациентами), условия оказания медицинской помощи (например, первичная/вторичная/третичная медицинская помощь, заболевания, поддающиеся самостоятельному лечению), характеристики источников данных (например, назначение, охват населения, элементы данных, терминология кодирования), уровни качества и достоверности данных, а также различные модели управления обменом данными и доступом к ним, что подчёркивается наличием различных национальных/региональных законов и нормативных актов. В настоящее время для определения пригодности данных РКП для получения адекватных доказательств в поддержку регуляторных решений требуется анализ в индивидуальном порядке, который может быть обусловлен разными критериями, связанными с вышеупомянутыми факторами и зависящими от вопроса (вопросов) исследования. В настоящее время не существует согласованных на международном уровне определений данных РКП и доказательств, основанных на данных РКП.
В документе «Рамки для FDA, США, Программа доказательств, основанных на данных РКП» (2018 г.) данные РКП определяются как «данные, касающиеся состояния здоровья пациента и/или оказания медицинской помощи, регулярно собираемые из различных источников», а доказательства, получаемые на основе данных РКП — как «клинические доказательства использования и потенциальной пользы или риска медицинского продукта, получаемые на основе анализа данных РКП». Доказательства, получаемые на основе данных РКП, могут быть получены в ходе разных исследований или анализов, включая РКИ, в том числе большие упрощённые рандомизированные исследования, прагматические клинические исследования и наблюдательные исследования (проспективные и/или ретроспективные), но не ограничиваясь ими».
В публикации, подготовленной исследователями из Европейского Союза, данные РКП определяются как «регулярно собираемые данные, относящиеся к состоянию здоровья пациента или оказанию медицинской помощи из различных источников, отличных от традиционных клинических исследований», а доказательства, получаемые на основе данных РКП, как «сведения, получаемые в результате анализа данных РКП».
Несмотря на схожесть этих определений (а также других, например от научных обществ, других регуляторных органов и т. д.), понятия «данные РКП» и «доказательства, получаемые на основе данных РКП» тем не менее используются непоследовательно и взаимозаменяемо. Применение разных определений ограничивает взаимодействие регуляторных органов в этой области.
В недавно опубликованных исследованиях была предпринята попытка определить частоту использования данных РКП и доказательств, основанных на данных РКП, при одобрении лекарственных средств и степень их использования для принятия решений. Различная интерпретация определений, неоднородные способы описания и характеристики источников данных РКП, а также различные методики, используемые в этих исследованиях, привели к разным оценкам количества заявлений на разрешение на продажу лекарственных средств, включающих данные РКП и доказательства, получаемые на основе данных РКП. Несмотря на то, что значительная и всё возрастающая доля разрешений на продажу содержит доказательства, получаемые на основе данных РКП, наблюдаемые расхождения могут приводить к различным уровням принятия того, что считается данными РКП и доказательствами, получаемыми на основе данных РКП в разных юрисдикциях.
В то время как вклад в мониторинг безопасности и эпидемиологии заболеваний на протяжении всего жизненного цикла лекарственных средств того, что сейчас называется данные РКП и доказательства, получаемые на основе данных РКП, давно признан, их использование для обоснования эффективности ещё только зарождается. Необходима дополнительная работа по углублённому анализу фактического вклада доказательств, основанных на данных РКП, в принятие регуляторных решений, причин, по которым в одних случаях такая информация не была признана надлежащей, а в других — способствовала одобрению. Эта работа также поможет дополнить существующие рекомендации разработчикам лекарственных средств в отношении предоставления доказательств, основанных на данных РКП (см. Приложение, включающее рекомендации регуляторных органов по данным РКП и доказательствам, получаемым на основе данных РКП, а также следующие публикации).
Национальные или региональные законы и нормативные акты могут препятствовать объединению и гармонизации терминологии и руководств, связанных с данными РКП и доказательствами, получаемыми на основе данных РКП. Однако достижение общего понимания на международном уровне терминологии и порядка применения данных РКП и доказательств, основанных на данных РКП, может сократить пробелы в знаниях о новых и существующих лекарственных средствах и будет способствовать расширению доступа к инновационным терапиям.
Цели и потенциальные выгоды
Цели аналитического доклада:
- привлечь ICH к работе по согласованию терминологии данных РКП и доказательств, основанных на данных РКП, формата протоколов и отчётов о результатах исследований, представляемых в регуляторные органы на протяжении всего жизненного цикла лекарственных средств, а также к работе по содействию регистрации протоколов и отчётов;
- обосновать оценку данных РКП и доказательств, основанных на данных РКП, для регуляторных целей.
Ожидается, что конечным результатом этой работы станет более высокое качество доказательств, основанных на данных РКП, способное внести существенный вклад в совокупность доказательств, подтверждающих принятие решений о пользе и риске лекарственного препарата.
Предлагается следующий поэтапный подход к гармонизации, при этом перед началом работы будет проведена переоценка объёма и направленности (см. табл. 1).
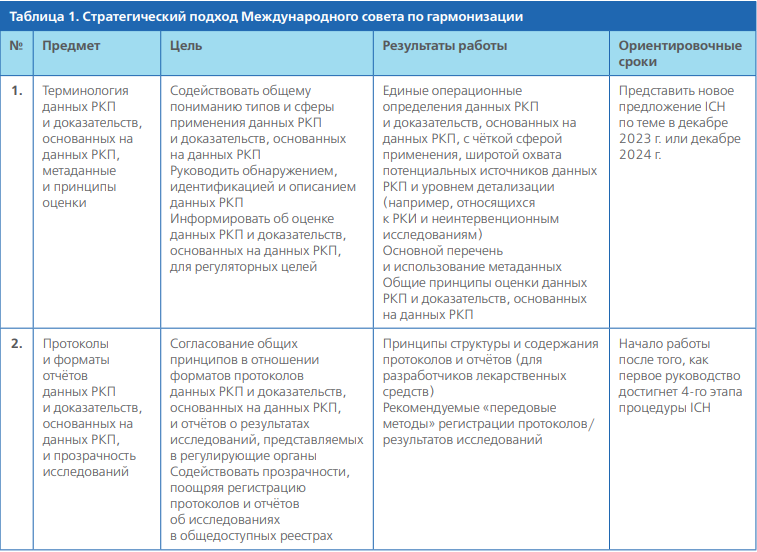
Документ представляет собой начальный этап поэтапного подхода к гармонизации регуляторного руководства по доказательствам, получаемым на основе данных РКП. Следующие вопросы могут быть рассмотрены в качестве приоритетных для последующих руководств ICH на основе мнений заинтересованных сторон:
- лучшие методы обеспечения качества данных;
- стандарты для данных РКП;
- надлежащее применение дизайна исследований и анализа данных.
Важные аспекты
Заинтересованные стороны и консультации.
Сложность использования и влияние данных РКП и доказательств, основанных на данных РКП, на регулирование лекарственных средств ставит множество проблем, поэтому мы признаём необходимость участия всех заинтересованных сторон. Если документ будет одобрен ICH, предлагается провести общественное обсуждение на основе опыта других руководств ICH, таких как ICH E6(R3), ICH E8 и ICH E17, чтобы обеспечить информирование всех заинтересованных сторон и предоставить им возможность высказать своё мнение по техническим и операционным аспектам, которые должны быть рассмотрены при гармонизации различных направлений, описанных выше. После проведения глобальных публичных обсуждений по документу и по мере продвижения работы над руководством в концептуальный документ и бизнес-план следует включить стратегию расширенных общественных обсуждений и вовлечения общественности.
Преимущества гармонизации ICH. Данное предложение будет нацелено на то, чтобы принести пользу всем видам лекарственных средств на любом этапе их жизненного цикла, т. е. от разработки и предварительного утверждения до пострегистрационного мониторинга безопасности. Руководство ICH может повысить эффективность использования ресурсов большим количеством заинтересованных сторон, согласовав ожидания органов регулирования лекарственных средств, разработчиков лекарственных средств или фармацевтической отрасли, групп защиты прав пациентов, контрактных исследовательских организаций, научных кругов и других заинтересованных сторон, использующих данные РКП для получения доказательной базы по лекарственным средствам.
Поддерживая создание регуляторной системы, способной более гармонично интегрировать доказательства, получаемые на основе данных РКП, в заявления на одобрение лекарственных средств и принятие решений, предложение может способствовать принятию своевременных решений по разработке инновационных методов лечения, удовлетворению неудовлетворённых медицинских потребностей и обеспечению безопасного и эффективного использования лекарственных препаратов.
Взаимодействие с существующими и разрабатываемыми руководствами. В различных регионах, включая Европу, США и Канаду, но не ограничиваясь ими, был запущен ряд инициатив, направленных на оценку и обеспечение возможности использования доказательств, основанных на данных РКП, во всём спектре регуляторных сценариев использования, которые в конечном итоге приведут к разработке и применению лекарственных средств в интересах пациентов. В декабре 2018 г. FDA (США) опубликовала документ RWE Framework, призванный решить текущие проблемы, связанные с использованием данных РКП и доказательств, основанных на данных РКП. После этого в 2021 г. опубликованы проекты указаний по данным РКП и доказательствам, получаемым на основе данных РКП, в 2022 г. — окончательные указания по предоставлению документов с использованием данных РКП и доказательств, основанных на данных РКП, а в 2023 г. — проект указаний по исследованиям с внешним контролем. Health Canada (Здоровье Канады) также работает над оптимизацией использования доказательств, основанных на данных РКП, для обоснования принятия регуляторных решений, о чём говорится в уведомлении Сектора медицинских товаров и продуктов питания, впервые опубликованном в апреле 2019 г. В 2020 г. Целевая группа по большим данным HMA/EMA выпустила десять приоритетных рекомендаций, связанных с лекарственными препаратами для медицинского применения и относящихся к DARWIN-EU, включая разработку стратегии стандартизации данных Европейской сети регулирования лекарственных средств для обеспечения сближения с партнёрами по стандартам и руководствам, связанным с большими данными и доказательствами, получаемыми на основе данных РКП. Все эти инициативы будут способствовать разработке предлагаемых новых руководств ICH.
Предусматривается взаимодействие и взаимодополняемость с другими руководствами ICH, например, E6(R3) и Приложением II к нему, ICH M14, а также с разрабатываемым в настоящее время ICH M11. Руководство ICH M14 «Общие принципы планирования и проведения фармакоэпидемиологических исследований с использованием данных РКП для оценки безопасности лекарственных препаратов» направлено на сближение рекомендаций и лучших методов в разных юрисдикциях по планированию и проведению исследований безопасности с использованием данных РКП, при этом потенциал доказательств, основанных на данных РКП, может быть расширен до оценки эффективности лекарственных средств и анализа использования имеющихся на рынке лекарственных препаратов, применяемых в реальной клинической практике. Руководство ICH M11 «Клинический электронный структурированный гармонизированный протокол (CeSHarP)» описывает общие принципы построения протокола и подход к разработке отдельных сопутствующих документов — шаблона клинического электронного структурированного гармонизированного протокола ICH M11 и технической спецификации, которые приемлемы для всех регуляторных органов регионов ICH. Область применения руководства M11 распространяется только на протоколы клинических исследований, в то время как данные РКП используются в основном в неинтервенционных исследованиях. Предлагаемое руководство предусматривает согласование структуры отчётов об исследованиях в дополнение к протоколам исследований.
Потребуется приложить усилия для того, чтобы свести к минимуму дублирование и максимально использовать знания, полученные в рамках существующих проектов.
Учитывая, что для реализации этой инициативы необходимо задействовать соответствующий опыт (например, в области фармакоэпидемиологии, биостатистики, регуляторных наук) регуляторных органов и разработчиков лекарственных средств, а также оставить достаточно времени для доработки разрабатываемых руководств, предлагается долгосрочный план с поэтапным подходом. Такая стратегия поможет эффективно продвигаться к гармонизации терминологии, связанной с данными РКП и доказательствами, получаемыми на основе данных РКП, и передовых методов, обеспечивая при этом взаимодополняемость новых и существующих руководств.
Приложение
Регуляторные инициативы и руководства, относящиеся к данным РКП и доказательствам, получаемым на основе данных РКП
В следующей табл. 2 приведены примеры существующих регуляторных инициатив и руководств, связанных с данными РКП и доказательствами, получаемыми на основе данных РКП. Она не является полным перечнем планируемых или текущих мероприятий в различных юрисдикциях. Кроме того, существует множество других инициатив и руководств, не являющихся регуляторными, которые будут рассматриваться по мере выполнения данной работы (например, от научных обществ и других соответствующих проектов и заинтересованных сторон).
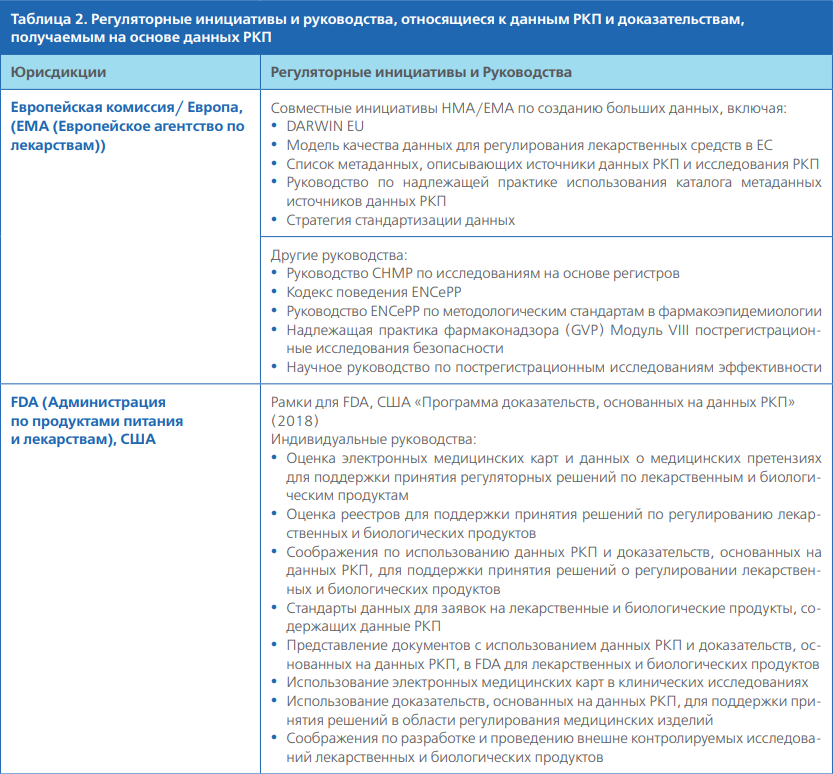

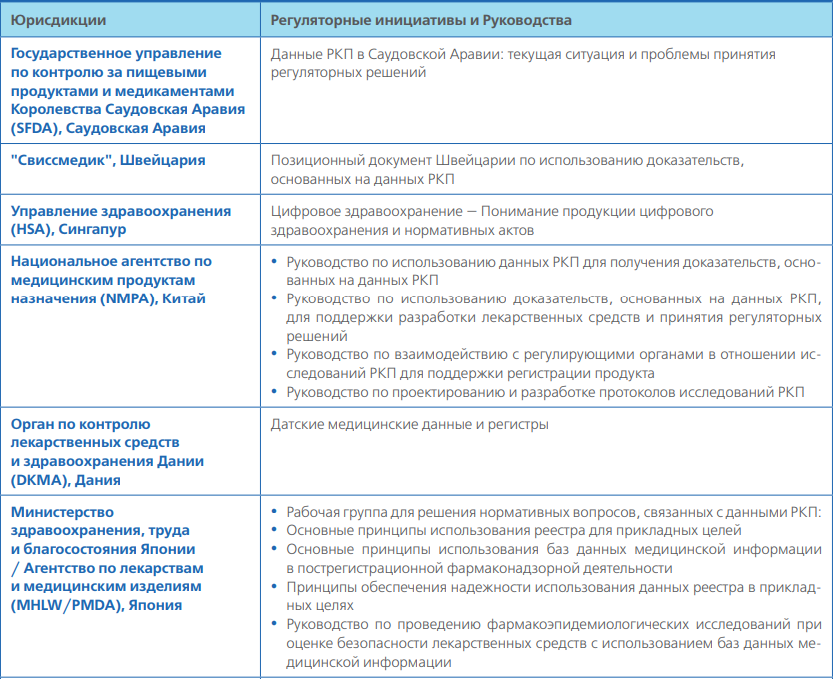

ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов.
Радаева К.С. декларирует отсутствие конфликта интересов; Ниязов Р.Р. консультирует фармацевтические компании по вопросу вывода лекарственных препаратов на рынок ЕАЭС.
Участие автора. Все соавторы подтверждают окончательный вариант статьи, ответственность за целостность всех частей статьи. Радаева К. С. — перевод оригинального материала; Ниязов Р. Р. — доработка перевода и редактирование.
ADDITIONAL INFORMATION
Conflict of interests.
Radaeva KS declares no conflict of interest; Niyazov RR advises pharmaceutical companies on bringing medicines to the EAEU market.
Participation of author. All authors are responsible for the integrity of all parts of the manuscript and approval of its final version. Radaeva KS — translation of the original material; Niyazov RR — finalization of translation and editing.
Список литературы
1. ICMRA Summit 2022. Dublin, Ireland, Tuesday 8th of November 2022. Интернет-ресурс. https://www.icmra.info/drupal/sites/default/files/2023-01/icmra_summit_2022_summary_report.pdf (Режим доступа: 03.09.2023).
2. ICH Reflection paper on proposed international harmonisation of real-world evidence terminology and convergence of general principles regarding planning and reporting of studies using real-world data, with a focus on effectiveness of medicines. EMA/CHMP/ ICH/295401/2023. Committee for Human Medicinal Products. 30 June 2023. Интернет-ресурс. https://www.ema.europa.eu/en/documents/scientific-guide-line/ich-reflection-paper-proposed-international-har-monisation-real-world-evidence-terminology_en.pdf (Режим доступа: 03.09.2023).
3. Framework for FDA’s Real-World Evidence Program. December 2018. Интернет-ресурс. https://www.fda.gov/media/120060/download (Режим доступа: 03.09.2023).
Об авторах
К. С. РадаеваРоссия
Радаева Ксения Сергеевна
Санкт-Петербург
Р. Р. Ниязов
Россия
Ниязов Равиль Рашидович
РИНЦ AuthorID: 591827
Москва
Конфликт интересов:
Ниязов Р.Р. консультирует фармацевтические компании по вопросу вывода лекарственных препаратов на рынок ЕАЭС
Рецензия
Для цитирования:
Радаева К.С., Ниязов Р.Р. Аналитический доклад Международного совета по гармонизации «Международная гармонизация терминологии доказательств, основанных на данных реальной клинической практики, и согласование общих принципов планирования и представления результатов исследований с использованием данных реальной клинической практики с акцентом на эффективность лекарств». Реальная клиническая практика: данные и доказательства. 2023;3(3):20-27. https://doi.org/10.37489/2782-3784-myrwd-38. EDN: EQMSZF
For citation:
Radaeva K.S., Niyazov R.R. ICH Reflection paper on proposed international harmonization of real-world evidence terminology and convergence of general principles regarding planning and reporting of studies using real-world data, with a focus on effectiveness of drugs. Real-World Data & Evidence. 2023;3(3):20-27. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-38. EDN: EQMSZF






























