Перейти к:
Перспективы использования аллостерических препаратов в реальной клинической практике
https://doi.org/10.37489/2782-3784-myrwd-43
EDN: FJVVUX
Аннотация
В то время как стало известно о клинической обоснованности использования аллостерической регуляции, учёные работают над открытием новых методов разработки аллостерических препаратов, которые могут модулировать функции ферментов, в зависимости от необходимого терапевтического эффекта, обладая более широким профилем безопасности по сравнению с альтернативными лекарственными средствами. Аллостерические модуляторы вызывают всё больший интерес в медицине, часть из них уже используется в клинике, а часть может быть потенциально использована в условиях реальной клинической практики. В данной статье обобщены текущие знания об аллостерической модуляции рецепторов и их клинических перспективах.
Ключевые слова
Для цитирования:
Свечкарева И.Р., Колбин А.С. Перспективы использования аллостерических препаратов в реальной клинической практике. Реальная клиническая практика: данные и доказательства. 2023;3(4):15-21. https://doi.org/10.37489/2782-3784-myrwd-43. EDN: FJVVUX
For citation:
Svechkareva I.R., Kolbin A.S. Prospects for the use of allosteric drugs in real-world clinical practice. Real-World Data & Evidence. 2023;3(4):15-21. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-43. EDN: FJVVUX
Актуальность
Одним из видов регуляции работы ферментов наряду с фосфорилированием и дефосфорилированием, белок-белковых взаимодействиями и ограниченным протеолизом является аллостерическая регуляция. Аллостерические ферменты наряду с активным (ортостерическим) сайтом содержат дополнительный (аллостерический) сайт, связывание с которым вызывает конфигурационные изменения активного центра, сопровождающиеся определённым эффектом. Этот тип регуляции может быть как активирующим, так и ингибирующим. Большинство подобных ферментов, являются ферментами метаболических путей синтеза или деградации клеточных молекул.
При аллостерическом ингибировании связывание молекулы с аллостерическим сайтом вызывает изменение формы, которое снижает сродство фермента к субстрату. Часто аллостерический ингибитор является продуктом фермента или ферментного пути, что позволяет ферментным продуктам ограничивать собственное производство — механизм отрицательной обратной связи [1].
В свою очередь аллостерический активатор вызывает конформационное изменение, которое увеличивает сродство фермента к субстрату (рис. 1). Аллостерическая активация резко увеличивает скорость реакции, что представлено S-образной реакцией скорость-субстрат.
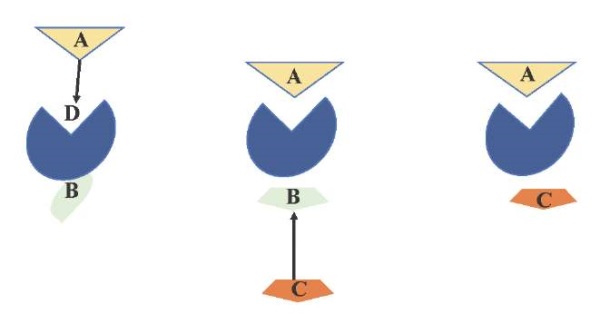
Рис. 1. Конформационное изменение ортостерического сайта
путём связывания аллостерического модулятора
Примечания: A — положительный аллостерический модулятор;
B — ортостерический сайт;
C — ортостерический лиганд;
D — аллостерический центр.
Аллостерические препараты представляют собой группу веществ, которые связываются с рецептором, изменяя реакцию этого рецептора на стимулы. За последнее десятилетие лекарственные препараты (ЛП), которые связываются с аллостерическими сайтами ферментов, являются перспективным направлением в разработке малых молекул. Данные ЛП открывают новые возможности для борьбы с различными заболеваниями, которые до недавнего времени считали «неизлечимыми».
В отличие от большинства известных ортостерических препаратов, которые связываются с эндогенным ортостерическим или активным сайтом целевого белка, аллостерические препараты избирательно связываются и модулируют функцию фермента в отдалённом от активного центра участке на поверхности белка. Этот уникальный механизм позволяет точно и селективно контролировать активность того или иного фермента, обеспечивая потенциальные преимущества по сравнению с применяемыми в практике малыми молекулами. Совершенствование информационных технологий и вычислительных моделей позволяет открывать новые, до настоящего времени неизвестные, участки аллостерического регулирования ферментов на основе 3D-моделирования белковых структур. Разрабатываемые аллостерические препараты в перспективе обещают быть более безопасными, более эффективными и приводить к лучшим клиническим исходам в терапии определённых заболеваний [1].
В последние годы развитие аллостерических модуляторов значительно возросло (рис. 1). Существуют работы, посвящённые не только внедрению аллостерических препаратов в клиническую практику, но и исследованиям способов улучшения фармакодинамических механизмов посредством создания ковалентной аллостерической модуляции.
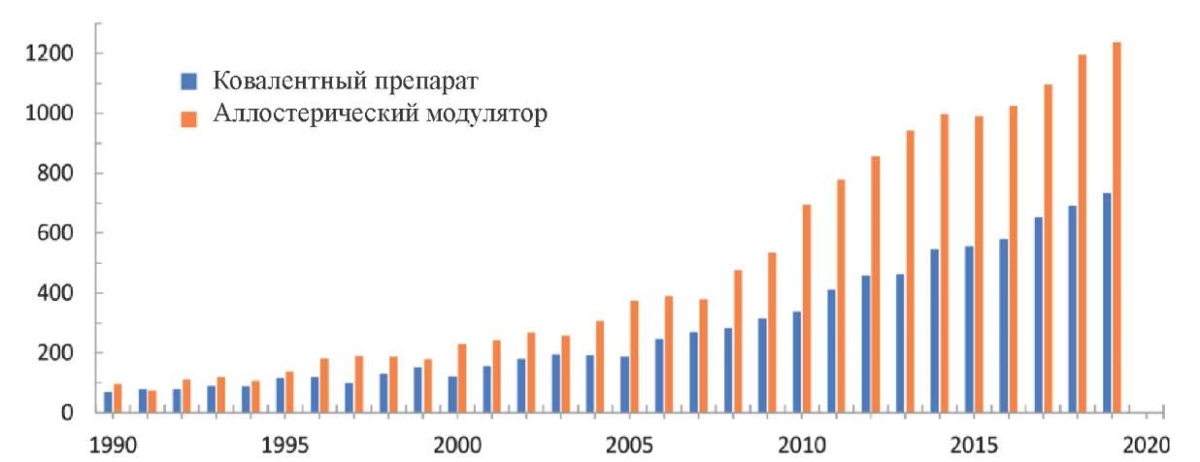
Рис. 2. Количество публикаций,
полученных в результате поиска терминов «Ковалентный препарат»
и «Аллостерический модулятор» в SciFinder® [1]
Ковалентные препараты необратимо связываются с рецептором, опосредуя ряд преимуществ подобных аллостерических препаратов. Большинство аллостерических модуляторов были случайно обнаружены в экспериментах по высокопроизводительному скринингу (англ. High-throughput Screening; HTS). Несмотря на развитие вычислительных подходов к прогнозированию аллостерических взаимодействий и мониторингу потенциальных аллостерических модуляторов в последние годы, всё ещё существуют ограничения, связанные с разработкой и открытием аллостерических модуляторов.
Одним из главных преимуществ аллостерических препаратов является их способность точно регулировать функцию ферментов. В то время как ортостерические препараты конкурируют с естественным субстратом, связывание с аллостерическим сайтом может ингибировать активность целевого белка неконкурентным образом, но в зависимости от терапевтической цели оно также может усилить функцию белка, не мешая связыванию эндогенного субстрата. Неконкурентная регуляция ферментативной функции обеспечивает больший контроль над такими процессами как взаимодействие с другими биологическими веществами.
Кроме того, по сравнению с ортостерическими препаратами, аллостерические препараты могут проявлять более высокую степень селективности, потому что аллостерические участки довольно уникальны, тем самым минимизируется потенциал нецелевых эффектов и снижается риск нежелательных лекарственных реакций, обеспечивая более целенаправленный и персонализированный подход к лечению.
Во многих случаях аллостерическое связывание является единственным способом воздействия на активность ферментов, которые характеризуются большими, сложными структурами или функциями, в которые трудно вмешиваться с помощью традиционных механизмов действия ЛП.
Аллостерические препараты эффективны против мутаций, возникающих в ответ на терапию ортостерическими препаратами онкологических и инфекционных заболеваний. В данной ситуации аллостерические и ортостерические препараты могут быть даны в комбинации. Таким образом, воздействуя на разные участки связывания, ни одна мутация не обеспечит устойчивость к обоим методам лечения, тем самым предотвращая прогрессирование заболевания через развитие резистентности.
Аллостерические модуляторы: новое поколение лекарственных препаратов
Доступные в настоящее время аллостерические препараты разделяют на две категории:
- положительные аллостерические модуляторы (англ. Positive Allosteric Modulator; PAM)
- отрицательные аллостерические модуляторы (англ. Negative Allosteric Modulator; NAM).
Применяемые PAM и NAM способны изменять способность эндогенного субстрата связываться с активным сайтом посредством аллостерической активации или ингибирования соответственно (см. рис. 3). PAM увеличивают аффинность лиганда к рецептору и увеличение его способности активировать рецептор, в свою очередь NAM снижают аффинность лиганда, тем самым ингибируя ту или иную функцию рецептора.
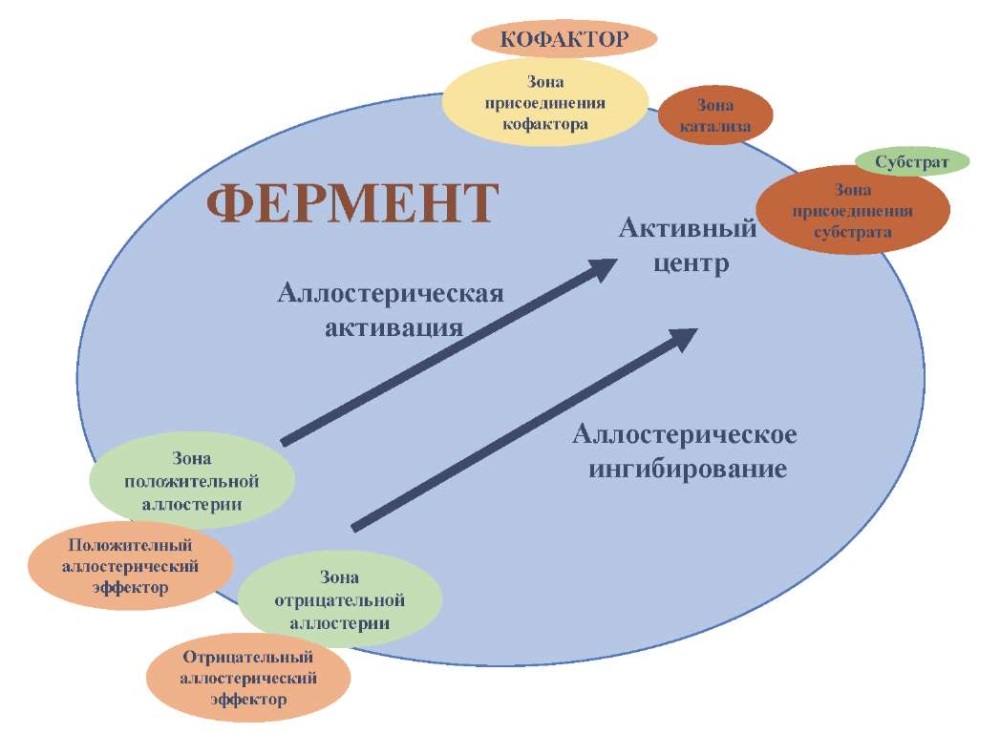
Рис. 3. Аллостерическая регуляция ферментативной активности
В то время как аллостерическая активация или ингибирование обеспечивает клинически значимые конформационные изменения патологических белков, необходимы новые способы развития аллостерической терапии в связи со сложностью строения белковой молекулы. В настоящее время ведутся работы по созданию новых аллостерических препаратов, которые позволяют точно настроить активность белка, модулируя их специфические связанные с заболеванием конформации или взаимодействия при сохранении нормальных физиологических функций организма.
Помимо активации и ингибирования, это следующее поколение аллостерических модуляторов обеспечивает стабилизацию, дестабилизацию и деградацию белка. Этот уровень контроля создаёт новые терапевтические возможности с потенциалом для достижения большей эффективности.
Перспективы применения в реальной клинической практике
Различные эффекты аллостерических препаратов могут найти клиническое применение для лечения мужского и женского бесплодия, а также различных эндокринных патологий.
Гонадотропные гормоны регулируют репродуктивную функцию, связываясь с рецепторами, связанными с G-белком: рецепторы фолликул-стимулирующего гормона (англ. Follicle-stimulating Hormone Receptor; FSHR) и рецептор лютеонизирующего гормона/хориогонадотропина (англ. Luteinizing Hormone/Choriogonadotropin Receptor; LHCGR). Они активируют несколько клеточно-специфических сигнальных путей, состоящих из внутриклеточных реакций, зависящих от лиганда. Сигнальные каскады могут быть модулированы синтетическими соединениями, которые связывают аллостерические сайты FSHR и LHCGR, или взаимодействием мембранных рецепторов. Несмотря на связывание гормона с ортостерическим сайтом, аллостерические лиганды могут изменить внутриклеточный сигнальный путь [3].
В контексте фертильности человека аллостерические препараты имеют период полураспада дольше, чем гормоны, тем самым отсутствует необходимость множественных инъекций, а также снижая риск синдрома гиперстимуляции яичников, который возникает при лечении хорионическим гонадотропином человека.
Аллостерические модуляторы могут использоваться и в контексте других патологических состояний, таких как синдром поликистозных яичников. Наличие аллостерических соединений, активных в FSHR и LHCGR, может модулировать активность гонадотропинов, потенциально уменьшая симптомы синдрома поликистозных яичников. Пациенты с синдром поликистозных яичников были предложены в качестве потенциальной целевой популяции для использования перорального аллостерического агониста TOP5300 [2]. Авторы продемонстрировали in vitro, что TOP5300 более эффективен, чем рекомбинантный фолликулостимулирующий гормон, в индуцировании выработки эстрадиола у женщин с синдромом поликистозных яичников, что свидетельствует о специфическом воздействии на данную группу пациентов. Аналогичные соединения могут участвовать в превращении андрогенов в эстрогены, устраняя гиперандрогенные эффекты, которые развиваются у данных пациентов. Аллостерические соединения могут использоваться для лечения бесплодия, так как возможно создание пролонгированных пероральных ЛП и отсутствия необходимости ежедневных инъекций [3].
Цинакальцет, первый аллостерический препарат, действующий на G-белок-сопряжённый рецептор (англ. G Protein-Coupled Receptor; GPCR), одобренный Управлением по контролю качества пищевых продуктов и лекарственных средств (англ. The Food and Drug Administration; FDA), действует как PAM, обладает кальциймиметическим действием, непосредственно снижающим уровень паратгормона, повышая чувствительность рецептора к внеклеточному кальцию. Два других PAM, эвокальцет и этелькальцетид прошли клинические исследования для лечения вторичного гиперпаратиреоза и семейной гипокальциурической гиперкальциемии I типа [3].
Рандомизированные контролируемые исследования на взрослых и детях продемонстрировали эффективное снижение паратиреоидного гормона кальцимиметиками вместе со снижением уровня кальция и фосфатов в сыворотке крови при использовании в комбинации с низкими дозами витамина D, в то время как терапия только ЛП витамина D увеличивала уровень кальция и фосфатов в сыворотке крови. Цинакальцет и этелкальцетид улучшают процессы остеогенеза, оказывая прямое анаболическое действие на костную ткань. Данные ЛП снижают количество частиц кальципротеина в сыворотке крови, которые участвуют в патогенезе формирования эндотелиальной дисфункции, атерогенеза и кальцификации сосудов. Клинические исследования на взрослых предполагают умеренное замедление прогрессирования сердечно-сосудистой кальцификации при применении цинакальцета [5]. В результате были сделаны выводы, что аллостерические модуляторы, которые специфически повышают чувствительность кальций-чувствительного рецептора, называемые кальцимиметиками, используемые в сочетании с активными метаболитами витамина D у взрослых пациентов на диализе, приводят к стойкому снижению уровня паратиреоидного гормона без повышенного уровня продукта кальция и фосфора. Если уровень кальция или фосфора в плазме высок при наличии повышенного уровня паратиреоидного гормона, кальцимиметики могут стать ЛП первого выбора [5]. У детей, находящихся на диализе, с персистирующим и тяжёлым гиперпаратиреозом при высоком уровне кальция, несмотря на традиционное лечение, включая активный витамин D, следует рассмотреть назначение цинокальцета, но с осторожностью ввиду недостаточных данных применения ЛП среди педиатрических пациентов [6].
С развитием нового поколения аллостерических препаратов возможно создание эффективных средств терапии болезни Паркинсона. Генетическая мутация лизосомального фермента глюкоцереброзидазы (англ. Glucocerebrosidase; GBA) является наиболее важным генетическим фактором риска развития данной патологии и затрагивает примерно 15 % пациентов [4]. Мутация вызывает дисфункциональное неправильные конформационные изменения GBA и последующее накопление α-синуклеина и последующую гибель нейронов.
В доклинических исследованиях аллостерический модулятор GT-02287, который в настоящее время разрабатывается Gain Therapeutics, предотвращает неправильную упаковку белка GBA, позволяя ферменту функционировать должным образом и восстанавливать функционирование лизосом, предотвращая агрегацию α-синуклеинов и гибель нейронных клеток. Этот пример демонстрирует, как следующее поколение аллостерических модуляторов может обеспечить эффективное лечение не только болезни Паркинсона, но и других нейродегенеративных заболеваний, характеризующихся дисфункцией GBA или накоплением α-синуклеина [4].
Gain Therapeutics разрабатывает низкомолекулярные структурно-направленные аллостерические регуляторы (англ. Structurally Targeted Allosteric Regulators; STAR), которые стабилизируют GCase, избегая его деградации, одновременно способствуя его сборке и транспортировке в лизосомы, обладая высокой биодоступностью при пероральном приёме и проникающие через гематоэнцефалический барьер. Повышение активности лизосомальной GCase с помощью GT-02287 защищает от ключевых патофизиологических механизмов развития болезни Паркинсона, включая патологию нейронов и лизосом, а также нарушение двигательных функций. Таким образом, STAR-терапия представляет собой новый фармакологический способ для лечения болезни Паркинсона, требующий дальнейшего изучения в клинической практике [7].
В результате изучения структуры рецептора фактора роста фибробластов и поиска возможных молекул, блокирующих его вне активного центра, был создан новый аллостерический ингибитор алофаниб (аллостерический ингибитор рецепторов фактора роста фибробластов 2 типа (FGFR2)). На основании данных доклинических исследований эффективности предполагается применение алофаниба для лечения онкологических заболеваний. Это первый из класса аллостерический ингибитор рецептора FGFR2, который отличается высокой избирательностью к опухолевым клеткам.
В экспериментальных исследованиях по изучению фармакологической активности ЛП показано, что он избирательно блокирует специфические участки рецептора FGFR2, подавляя рост злокачественных опухолей [9].
Значение машинного обучения
Несмотря на огромный потенциал, разработка аллостерических препаратов представляет собой несколько проблем. Выявление подходящих аллостерических участков в белках-мишенях и проектирование молекул, которые могут связываться с этими сайтами с высоким сродством и селективностью, остаётся сложной задачей. Тем не менее, достижения в вычислительном моделировании 3D-конформаций белка, основанные на фундаментальных физических моделях, могут выявить лекарственные аллостерические сайты, которые ранее не были известны. Те же методы в сочетании с машинным обучением и другими методами интеллектуальных технологий позволяют исследователям проверять огромные коллекции виртуальных соединений, что позволяет обнаружить и оптимизировать аллостерические препараты [4].
Несмотря на значительный прогресс, достигнутый в данной области с начала тысячелетия, выявление аллостерических препаратов для терапевтических мишеней и выяснение аллостерических механизмов все еще представляют собой существенные проблемы. Эти проблемы вытекают из трудностей в идентификации аллостерических сайтов и мутаций, оценке аллостерических взаимодействий белка-модулятора, скрининга аллостерических модуляторов и выяснения аллостерических механизмов в биологических системах. Для решения этих проблем за последнее десятилетие разработана панель аллостерических услуг для конкретных аллостерических приложений, включая создание Allosteric Database с целью предоставления всеобъемлющей аллостерической информации, такой как аллостерические белки, модуляторы, сайты, пути и т. д., построение эталона ASBench высококачественных аллостерических сайтов для разработки вычислительных методов прогнозирования аллостерных участков, разработка Allosite и AllositePro для прогнозирования местоположения аллостерических участков в белках, разработка оценочной функции Alloscore для оценки взаимодействия аллостерического белка и модулятора, разработка аллостеротома для эволюционного анализа аллостерических сайтов/модуляторов запроса в протеоме человека, разработка AlloDriver для прогнозирования аллостерического мутагенеза и разработка AlloFinder для виртуального скрининга аллостерических модуляторов и исследования аллостерических механизмов. Ожидается, что эти аллостерические инновации ускорят обнаружение аллостерических препаратов и исследование аллостерических механизмов [12].
Объединив эти передовые разработки, становится возможным идентификация и проектирование малых молекул, которые избирательно связываются с аллостерическими участками, обладающих высоким сродством к рецептору и специфичностью, что в итоге приводит к разработке инновационных и эффективных аллостерических препаратов для лечения сложных заболеваний.
Заключение
Аллостерическая регуляция имеет ряд преимуществ, связанных с особенностями расположения сайта и функционального значения. Родственные рецепторы имеют схожие ортостерические центры, в отличие от аллостерических. Это объясняет перспективность аллостерических препаратов, так как они очень специфичны и воздействуют на ограниченный набор рецепторов.
Изучение этих новых неклассических аллостерических сайтов расширит разнообразие аллостерического контроля функции ортостерических участков в белках, будь то GPCR или другие рецепторы, ферменты или транспортеры. Кроме того, разработка новых ЛП, нацеленных на эти скрытые аллостерические участки или уже известные ортостерические участки, действующие в качестве аллостерических участков в белковых гомо- или гетероолигомерах, увеличит терапевтический потенциал данной терапии [10].
Наличие лекарственных, топографически различных аллостерических сайтов среди широкого спектра рецепторов предложило новые парадигмы для малых молекул для модуляции функции клеток.
Кроме того, лиганды, нацеленные на аллостерические участки имеют ряд преимуществ перед соответствующими ортостерическими лигандами с точки зрения селективности [11].
Быстрое увеличение внимания к аллостерическим модуляторам можно объяснить несколькими ключевыми преимуществами, которые имеют такие лиганды по сравнению с ортостерическими лигандами. Во-первых, аллостерические участки демонстрируют большее структурное разнообразие по сравнению с более консервативными ортостерическими участками. Таким образом, это может привести к более высокой степени селективности для тесно связанных белков. Однако существует определённый набор недостатков применения аллостерических лигандов. Высокая специфичность аллостерических участков приводит к их различиям между видами, которые могут помешать оценке фармакологической безопасности ЛП. Аллостерические соединения, как правило, не конкурируют с эндогенным лигандом рецептора. Таким образом, аллостерические модуляторы в итоге могут быть использованы при более низких концентрациях, что приведёт к снижению побочных эффектов. Кроме того, в случае лекарственно-устойчивых мутаций в ортостерическом сайте связывания аллостерические лиганды могут представлять собой многообещающий альтернативный способ воздействия.
Несмотря на перечисленные преимущества проблема обнаружения аллостерических препаратов является весьма актуальным ограничением, поскольку аллостерические участки часто не идентифицируются или не имеют конкретных форматов анализа для скрининга целевых лигандов [11].
По мере развития области аллостерической модуляции различных рецепторов, появляются ключевые принципы и стратегии для разработки лигандов/лекарств для аллостерических участков. Аллостерические лиганды, нацеленные на GPCR, вышли на рынок и, наряду с ингибиторами аллостерической киназы, находятся на различных стадиях клинической разработки для широкого спектра нарушений центральной нервной системы и онкологических заболеваний.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов.
Авторы декларируют отсутствие конфликтов интересов.
Участие автора. Свечкарева И.Р. — написание текста; Колбин А.С. — редактирование, оформление статьи.
ADDITIONAL INFORMATION
Conflict of interests.
The authors declare no conflict of interest.
Participation of author. Svechkareva IR — text writing; Kolbin AS — editing, article design.
Список литературы
1. Bian Y, Jun JJ, Cuyler J, Xie XQ. Covalent allosteric modulation: An emerging strategy for GPCRs drug discovery. Eur J Med Chem. 2020 Nov 15;206:112690. doi: 10.1016/j.ejmech.2020.112690.
2. Nataraja S, Yu H, Guner J, Palmer S. Discovery and Preclinical Development of Orally Active Small Molecules that Exhibit Highly Selective Follicle Stimulating Hormone Receptor Agonism. Front Pharmacol. 2021 Jan 14;11:602593. doi: 10.3389/fphar.2020.602593. Erratum in: Front Pharmacol. 2021 Mar 31;12:672778.
3. Lazzaretti C, Simoni M, Casarini L, Paradiso E. Allosteric modulation of gonadotropin receptors. Front Endocrinol (Lausanne). 2023 May 25;14:1179079. doi: 10.3389/fendo.2023.1179079.
4. Allosteric drugs: A differentiated small molecule approach: https://www.drugdiscoverytrends.com/allos-teric-drugs-a-differentiated-small-molecule-approach/
5. Bernardor J, De Mul A, Bacchetta J, Schmitt CP. Impact of Cinacalcet and Etelcalcetide on Bone Mineral and Cardiovascular Disease in Dialysis Patients. Curr Osteoporos Rep. 2023 Apr;21(2):193-204. doi: 10.1007/s11914-023-00782-x.
6. Capossela L, Ferretti S, D'Alonzo S, et al. Bone Disorders in Pediatric Chronic Kidney Disease: A Literature Review. Preprints.org; 2023. DOI: 10.20944/preprints202309.2108.v1.
7. B. Guzman, N. Perez, A. Garcia-Collazo, E. Cubero, X. Barril, M. Bellotto, A. Henriques, L. Rouviere, R. Maj. GT-02287, a brain-penetrant structurally targeted allosteric regulator for glucocerebrosidase show evidence of pharmacological efficacy in conduritol β-epoxide (CBE) models of Parkinson’s disease [abstract]. Mov Disord. 2022; 37 (suppl 2). https://www.mdsabstracts.org/abstract/gt-02287-a-brain-penetrant-structurally-targeted-allosteric-regulator-for-glucocere-brosidase-show-evidence-of-pharmacological-efficacy-in-conduritol-%ce%b2-epoxide-cbe-models-of-parkinsons/. Accessed December 12, 2023.
8. Kuo CL, Kallemeijn WW, Lelieveld LT, Mirzaian M, Zoutendijk I, Vardi A, Futerman AH, Meijer AH, Spaink HP, Overkleeft HS, Aerts JMFG, Artola M. In vivo inactivation of glycosidases by conduritol B epoxide and cyclophellitol as revealed by activity-based protein profiling. FEBS J. 2019 Feb;286(3):584-600. doi: 10.1111/febs.14744.
9. Лапина Н.В., Стосман К.И., Мелихова М.В., Вакуненкова О.А., Батоцыренова Е.Г., Кашуро В.А., Рожко М.А. Доклиническое токсикологическое изучение алофаниба — аллостерического ингибитора рецептора фактора роста фибробластов 2 типа. Злокачественные опухоли. 2019;9(3):65-70. https://doi.org/10.18027/2224-5057-2019-9-3-65-70.
10. Wenthur CJ, Gentry PR, Mathews TP, Lindsley CW. Drugs for allosteric sites on receptors. Annu Rev Pharmacol Toxicol. 2014;54:165-84. doi: 10.1146/annurev-pharmtox-010611-134525.
11. Ni D, Li Y, Qiu Y, Pu J, Lu S, Zhang J. Combining Allosteric and Orthosteric Drugs to Overcome Drug Resistance. Trends Pharmacol Sci. 2020 May;41(5):336348. doi: 10.1016/j.tips.2020.02.001.
12. Lu S, Shen Q, Zhang J. Allosteric Methods and Their Applications: Facilitating the Discovery of Allosteric Drugs and the Investigation of Allosteric Mechanisms. Acc Chem Res. 2019 Feb 19;52(2):492-500. doi: 10.1021/acs.accounts.8b00570.
Об авторах
И. Р. СвечкареваРоссия
Свечкарева Изабелла Размиковна — Ординатор кафедры клинической фармакологи и доказательной медицины
Санкт-Петербург
А. С. Колбин
Россия
Колбин Алексей Сергеевич — д. м. н., профессор, зав. кафедрой клинической фармакологии и доказательной медицины; профессор кафедры фармакологии
Санкт-Петербург
Рецензия
Для цитирования:
Свечкарева И.Р., Колбин А.С. Перспективы использования аллостерических препаратов в реальной клинической практике. Реальная клиническая практика: данные и доказательства. 2023;3(4):15-21. https://doi.org/10.37489/2782-3784-myrwd-43. EDN: FJVVUX
For citation:
Svechkareva I.R., Kolbin A.S. Prospects for the use of allosteric drugs in real-world clinical practice. Real-World Data & Evidence. 2023;3(4):15-21. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-43. EDN: FJVVUX
JATS XML






























