Перейти к:
Социальная значимость ревматических заболеваний, негативные последствия для системы здравоохранения и пути профилактики
https://doi.org/10.37489/2782-3784-myrwd-070
EDN: HWOQXK
Аннотация
Актуальность. Иммуновоспалительные ревматические заболевания (ИВРЗ) представляют собой значительную медико-социальную проблему, ведущую к высокой смертности, инвалидизации и экономическому бремени для общества. Эти заболевания, такие как ревматоидный артрит (РА), псориатический артрит (ПсА) и аксиальный спондилоартрит (аксСпА), существенно снижают качество жизни пациентов и увеличивают финансовую нагрузку на системы здравоохранения.
Цель. Цель настоящего систематического обзора — оценить текущие данные о риске смерти у пациентов с ИВРЗ и выявить факторы, ассоциированные с повышенной летальностью, а также проанализировать эффективность биологических препаратов в снижении этого риска.
Материалы и методы. Обзор включает данные из множества клинических исследований и метаанализов, охватывающих период с 2000 по 2021 год. Анализ проводился на основе данных, собранных из различных источников, включая национальные регистры, клинические исследования и метаанализы.
Результаты. Основные результаты показывают, что ИВРЗ, такие как РА, ПсА и аксСпА, значительно увеличивают риск смерти по сравнению с общей популяцией (SMR 2,02 1,79; 2,29). Активность заболевания, курение и коморбидные состояния являются ключевыми факторами, увеличивающими риск летальности. Использование генно-инженерных биологических препаратов (ГИБП) в терапии снижает риск смерти по сравнению с отсутствием биологической терапии (ОР (HR) 0,52 0,32; 0,86) и по сравнению с метотрексатом (ОР (HR) 0,77 0,60; 0,97). Применение ГИБП также снижает риск сердечно-сосудистых событий и развития деменции.
Выводы. Раннее и активное использование ГИБП может стать значимым фактором в снижении негативных последствий ИВРЗ, включая смертность и прогрессирование сердечно-сосудистых заболеваний.
Заключение. Результаты систематического обзора могут быть полезны для разработки стратегий управления ИВРЗ и оптимизации медицинской помощи пациентам. Внедрение ГИБП в терапию ИВРЗ может существенно улучшить прогноз и качество жизни пациентов, снижая риск летальности и других неблагоприятных исходов.
Ключевые слова
Для цитирования:
Лила А.М., Королев М.А., Щендригин И.Н., Сапожников К.В., Лазарев А.А., Саблева Н.А., Толкачева Д.Г. Социальная значимость ревматических заболеваний, негативные последствия для системы здравоохранения и пути профилактики. Реальная клиническая практика: данные и доказательства. 2025;5(2):5-15. https://doi.org/10.37489/2782-3784-myrwd-070. EDN: HWOQXK
For citation:
Lila A.M., Korolev M.A., Shchendrigin I.N., Sapozhnikov K.V., Lazarev A.A., Sableva N.A., Tolkacheva D.G. Social significance of rheumatic diseases, negative consequences for the health care system and ways of prevention. Real-World Data & Evidence. 2025;5(2):5-15. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-070. EDN: HWOQXK
Введение / Introduction
Иммуновоспалительные ревматические заболевания (ИВРЗ), несмотря на усилия систем здравоохранения во всём мире, остаются одной из насущных проблем, имеющих большое медико-социальное значение, в том числе и из-за генерации значимого экономического бремени для общества. Также при большинстве этих заболеваний: ревматоидном артрите (РА), аксиальном спондилоартрите (аксСпА), системных заболеваниях соединительной ткани (СЗСТ) и других, наблюдается существенное снижение качества жизни пациентов, в том числе из-за хронической боли, ограничения подвижности суставов, поражения жизненно-важных органов и систем организма. Это влечёт за собой увеличение финансовой нагрузки на государство из-за высокой стоимости лечения, частой инвалидизации пациентов и необходимости длительного диспансерного наблюдения [1–3].
Так, ИВРЗ в течение последних десятилетий остаются одной из ведущих причин развития инвалидности во многих странах, что обусловливает существенную дополнительную нагрузку на государство за счёт недополучения валового внутреннего продукта и связанных с этим целым рядом социальных проблем [4–8]. Вместе с тем ущерб государству от ИВРЗ, распространённость которых, по некоторым оценкам [9], существенно превышает официальную статистику и имеет тенденцию к дальнейшему росту, не ограничивается лишь инвалидизацией пациентов. Помимо ограничений физического функционирования, наличие аутоиммунного ревматического заболевания создаёт значительный риск как возникновения осложнений со стороны жизненно-важных органов и систем, в т. ч. кардиоваскулярной, так и летального исхода. Проанализировать имеющуюся информацию по данной проблеме, возможные пути снижения летальности таких пациентов и явилось целью настоящего обзора.
Материалы и методы / Materials and methods
В рамках подготовки публикации был проведён систематический обзор литературы в базе данных PubMed. Поисковый запрос включал различные ревматические заболевания, такие как ПсА, аксСпА, системная красная волчанка, синдром Шегрена, системная склеродермия и другие, а также такие ключевые слова, как смертность, стандартизированная смертность и смерть. Поиск был ограничен публикациями на английском языке в период с 2000 по 2021 год с фильтром по рандомизированным клиническим исследованиям. Было найдено 35 327 статей, из которых 24 были отобраны как наиболее релевантные. Диаграмма отбора публикаций PRISMA представлена на рис. 1. Анализ проводился на основе данных, собранных из национальных регистров, клинических исследований и метаанализов.
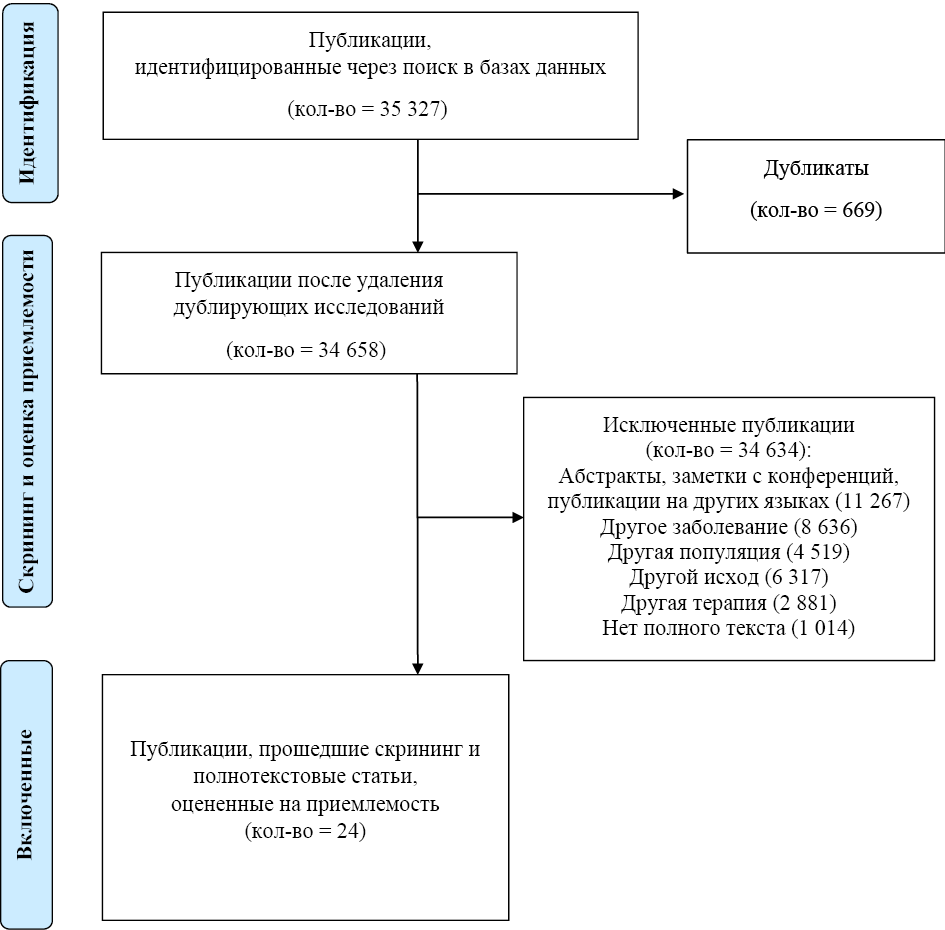
Рис. 1. Диаграмма отбора публикаций PRISMA
Fig. 1. PRISMA publication selection diagram
Результаты / Results
Вопрос оценки риска смерти при ИВРЗ изучается достаточно долго. Так, Rodriguez-Rodriguez et al. [10] на данных рутинной практики медицинского центра г. Мадрида с 2000 по 2004 гг. показали, что смертность от всех причин больных РА без применения метотрексата (МТ) или ГИБП составила 28,4 событий на 1000 пациенто-лет, в то время как на фоне их приёма она сократилась до 12. В целом, авторами отмечено, что применение любых базисных препаратов, изменяющих течение РА, приводит почти к двухкратному снижению риска смерти пациентов (ОР (HR) = 0,52 [ 0,32; 0,86]). По данным Jacobsson et al. [11], активность заболевания, оцениваемая пациентом, является неблагоприятным предиктором: один балл по опроснику HAQ связан с повышением риска летального исхода в 1,58 [ 1,37; 1,82] раза, а по визуальной аналоговой шкале боли — в 1,30 [ 1,15; 1,50] раза. Активное лечение ГИБП, в частности, ингибиторами фактора некроза опухоли-альфа (иФНО-α), направленное на снижение выраженности воспаления, согласно данным этих авторов, способствует редукции в среднем на 35 % угрозы смерти (ОР (HR) = 0,65 [ 0,46; 0,93], с коррекцией на половозрастные особенности, соматический статус и активность заболевания).
По данным метаанализа Aviña-Zubieta et al. [12], у больных с РА, помимо общей летальности, наблюдается увеличение смертности от кардиоваскулярных причин. Так, на материале 24 клинических исследований, в которых приняли участие свыше 100 тысяч пациентов, было показано, что риск умереть от заболеваний сердечно-сосудистой системы выше на 50 %: отношение стандартизованных частот смертности (SMR) составило 1,50 [ 1,39; 1,61].
Следует отметить, что по результатам подгруппового сравнения более ранних (до 1987 года) и более поздних исследований (с 1987 года и до 2008 года), существенных различий в смертности у пациентов с ИРВЗ выявлено не было. Это свидетельствует об отсутствии значимого прогресса в терапии, так как до 2008 года стандарты лечения не включали ГИБП. В ранние периоды (до 1987 года) стандарты лечения включали преимущественно нестероидные противовоспалительные препараты (НПВП) и глюкокортикоиды (ГК), а в период с 1987 по 2008 год — традиционные базисные противовоспалительные препараты (БПВП), в частности, метотрексата (МТ). После 2008 года началось активное использование ГИБП, что привело к значительному снижению смертности и улучшению прогноза заболевания.
При этом противоречий во мнении исследователей относительно данного факта не было уже в 2009 году [13], когда РА был поставлен на одну ступень с сахарным диабетом 2 типа по степени влияния на сердечно-сосудистый риск (ССР) [14]. Исследование данной проблемы на протяжение последних лет подтверждают прочное место РА среди других факторов ССР [15].
В целом, РА является одним из наиболее хорошо изученных ИВРЗ, при котором рекомендуется всесторонний контроль риска сердечно-сосудистых событий (ССС) и смертности [16]. В частности, van Nies et al. [17] впервые показали, что назначение новых на период до 2008 гг. ГИБП и обеспечение раннего доступа к ним сопряжены с существенным снижением вероятности смерти у пациентов с РА. Позже данный тезис был подтверждён в метаанализах Barnabe et al. [18] в отношении и риска ССС. Так, применение иФНО-α в терапии РА снижают риск наступления «больших» ССС на 54 % (ОР (RR) 0,46 [ 0,28; 0,77]), инфаркта миокарда (ИМ) и ишемического инсульта (ИИ) — на 19 и 31 % по сравнению с отсутствием такой терапии (ОР (RR) для ИМ 0,81 [ 0,68; 0,96], для ИИ — 0,69 [ 0,53; 0,89]). Исследования и других ГИБП, в частности, ритуксимаба (РТМ) [19], также показали позитивное и более существенное по сравнению с сБПВП на риск развития летальных исходов: по сравнению с МТ, терапия ГИБП способствовала снижению риска на 23 % (ОР (HR) 0,77 [ 0,60; 0,97]). При сравнении РТМ (ОР (HR) 0,57 [0,39; 0,84]) и иФНО-α (ОР (HR) 0,64 [ 0,50; 0,81]) было показано сопоставимое влияние на выживаемость пациентов в течение первого года терапии. К негативным последствиям РА можно отнести и развитие у ряда пациентов деменции, профилактика которой также возможна при помощи включения ГИБП в тактику лечения [20].
Одним из ключевых факторов в развитии деменции считается хроническое системное воспаление, в том числе нарушение регуляции воспалительных цитокинов, таких как ФНО и ИЛ-6. Эти же механизмы также играют роль в патогенезе РА, что связывает эти два заболевания с точки зрения патофизиологии. В метаанализе Xie et al. [20] была изучена связь между применением различных БПВП и риском развития деменции. Результаты показали, что использование ГИБП ассоциируется с примерно 24 % снижением риска деменции по сравнению с применением сБПВП. Среди ингибиторов ФНО наибольшую защиту обеспечивал этанерцепт, снижая риск когнитивного дефицита на 42 %, за ним следовали адалимумаб и инфликсимаб с меньшим эффектом. Применение сБПВП в целом не приводило к значимому снижению риска деменции, за исключением сульфасалазина, который, напротив, был связан с повышением риска.
Больные с РА имеют более высокий риск смертности, чем население в целом. Показатели смертности у лиц с РА примерно в 1,5 раза выше, чем в общей популяции, с аналогичными закономерностями за последние 50 лет [21]. Эпидемиологические данные продемонстрировали повышенный риск сердечно-сосудистых заболеваний (ССЗ) у больных РА. Традиционные факторы риска ССЗ могут частично способствовать развитию ССЗ при РА; однако современные данные подчёркивают важную роль воспаления в патогенезе атеросклероза и усилении риска ССЗ [22–27]. Результаты исследования Humphreys et al. [28], выполненного по данным Норфолкского регистра артритов (англ. The Norfolk Arthritis Register; NOAR), подтвердили наличие тренда повышенной смертности у пациентов с ранним РА: больные с серопозитивным РА имели увеличенный в 1,39 [ 1,18; 1,65] раза риск неблагоприятного исхода.
По данным более позднего метаанализа Toledano et al. [29] показано серьёзное влияние ИВРЗ на смертность пациентов (рис. 2). Совокупное SMR составило 2,02 [ 1,79; 2,29]. Наиболее грозными патологиями были определены первичные системные васкулиты с почти 5-кратным увеличением смертности и системная склеродермия, увеличивающая летальный риск в 3,5 раза.
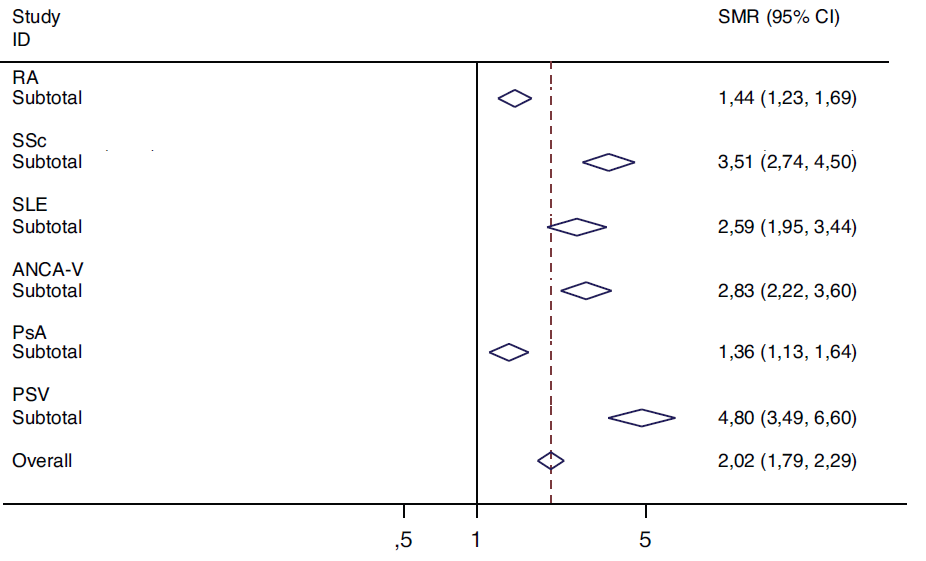
Рис. 2. Итоговые результаты оценки влияния ревматической нозологии на смертность пациентов (по данным Toledano et al., [29])
Fig. 2. Final results of the assessment of the impact of rheumatic nosology on patient mortality (according to Toledano et al., [29])
Примечания: RA — ревматоидный артрит; SSc — системная склеродермия; SLE — системная красная волчанка; ANCA-V — АНЦА-ассоциированные васкулиты; PsA — псориатический артрит; PSV — первичные системные васкулиты.
Notes: RA — rheumatoid arthritis; SSc — systemic sclerosis; SLE — systemic lupus erythematosus; ANCA-V — ANCA-associated vasculitides; PsA — psoriatic arthritis; PSV — primary systemic vasculitides.
Значительный вклад всей группы ИВРЗ в повышении летальности показан и в относительно недавнем исследовании реальной клинической практики, выполненном Bournia et al. [30]. Ведущей патологией, согласно данным авторов, являются системная склеродермия (ССД) и системная красная волчанка (СКВ). Вместе с тем, как подчёркивают исследователи, за последнее время качество оказания медицинской помощи пациентам с ИВРЗ существенно улучшилось, за счёт чего выживаемость пациентов приблизилась к общепопуляционной. В качестве рекомендаций авторы предлагают обеспечить более широкий доступ пациентов к новым терапевтическим опциям и существенно улучшить контроль за коморбидными состояниями.
Комбинированное исследование, выполненное в 2021 году Dadoniene et al. [31] и включавшее анализ данных национального регистра Литвы, согласуется с результатами Toledano et al. [29] в отношении всей группы ревматических заболеваний. Следует отметить, что, включив собственные данные в метаанализ, авторы получили аналогичные результаты, показав репрезентативность когорт ревматологических больных Литвы на популяции других стран. Также авторами были проведены расчёты и показан ущерб ожидаемой продолжительности жизни из-за РА и группы аксСпА (минус 1,63 и 2,7 лет соответственно).
Согласно данным метаанализа Rubio-Rivas et al. [32], в котором подтверждено существенное влияние ССД на уровень смертности пациентов, показано также, что данный показатель по результатам более поздних исследований снизился на 38,5 % — с 3,35 [ 1,57; 7,11], имевший место до 1990 года, до 2,42 [ 1,89; 3,11] в настоящее время. Такую динамику можно объяснить, главным образом, за счёт улучшения качества оказания медицинской помощи пациентам и большей (и более ранней) доступностью современных терапевтических опций.
Вместе с тем, структура факторов риска летальных исходов на фоне РА и других ИВРЗ за последние годы значимо не поменялась: высокая активность воспаления и образ жизни остались основными причинами, обусловливающими сохранение каскада негативных процессов, приводящих к более высокой летальности пациентов, страдающих ИВРЗ. Согласно данным мультивариативного анализа, выполненного van Nies et al. [17], выявлено более чем двукратное увеличение риска смерти на фоне курения или развития эрозивного артрита. Степень связи опросника HAQ с летальностью осталась неизменной по сравнению с предыдущими исследованиями. Более поздние данные, в частности, Listing et al. [19], показали, что активность РА по индексу DAS28 более 5,1 и наличие коморбидности также являются существенными факторами, снижающими выживаемость пациентов (рис. 3). Современные данные регистров, например, исследование RABBIT в Германии [33], также показывают весомый вклад, который оказывают высокая воспалительная активность воспаления и коморбидные состояния на данный показатель.
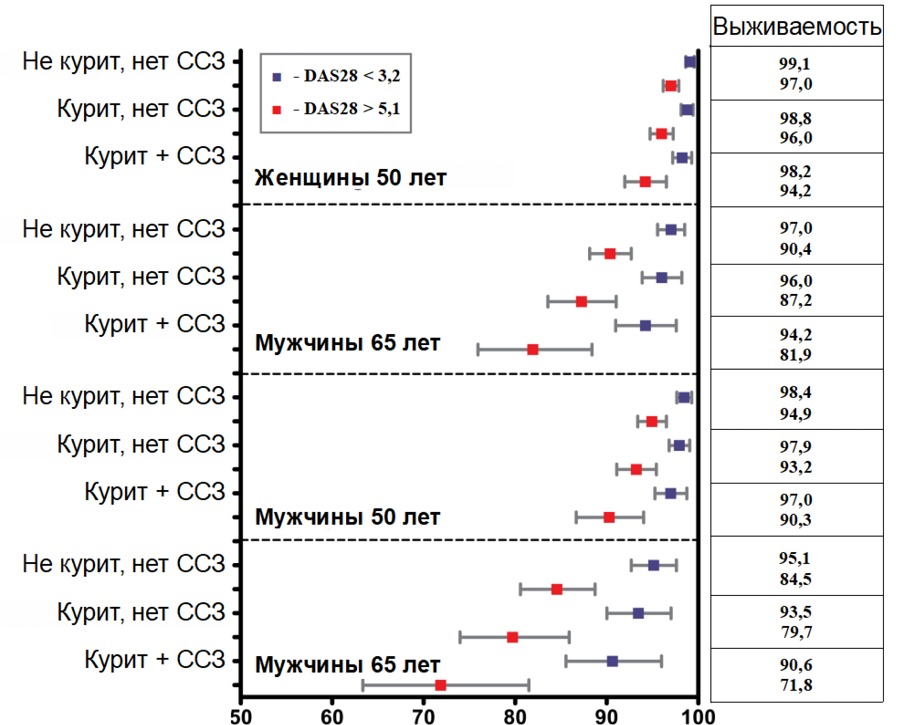
Рис. 3. Влияние факторов риска на выживаемость пациентов с ревматоидным артритом (по Listing et al., [19])
Fig. 3. The influence of risk factors on the survival of patients with rheumatoid arthritis (according to Listing et al., [19])
Примечание: ССЗ — сердечно-сосудистые заболевания.
Note: CVD — cardiovascular disease.
Обсуждение / Discussion
Актуальность изучения ИВРЗ связана не только с их высокой распространённостью в популяции, но и в связи с тяжёлым бременем для граждан, системы здравоохранения и общества в целом не только за счёт ограничения жизнедеятельности и частой инвалидизации пациентов, но и в результате высокой смертности, риска развития ССС и других негативных последствий, в том числе деменции. Данное обстоятельство диктует необходимость совершенствования терапевтических и организационных подходов к ведению пациентов с ИВРЗ.
Совершенна очевидна в настоящее время важность раннего активного лечения ИВРЗ, в том числе с применением ГИБП, с целью замедления прогрессирования и профилактики ограничений жизнедеятельности пациентов [27]. В данном обзоре на основании анализа данных литературы было показано, что раннее и более широкое назначение ГИБП пациентам с ИВРЗ может стать значимым фактором контроля развития коморбидных состояний и модификации образа жизни, что будет способствовать снижению социально-экономических последствий, связанных со смертностью и прогрессированием ССЗ у данной категории больных.
По мнению большинства исследователей, существенным недостатком современной инновационной терапии ИВРЗ с использованием ГИБП и тБПВП (ингибиторов янус-киназ) остаётся её высокая стоимость [4]. Вместе с тем, ощутимый эффект от применения ГИБП в виде снижения ССР, смертельных и других неблагоприятных исходов в сочетании со снижением частоты инвалидизации пациентов является более значимым по сравнению с финансовыми затратами на лекарственные препараты, что склоняет чашу весов системы оценки «эффект-затраты» в сторону эффективности терапии с применением ГИБП. Отдельно следует отметить, что только всесторонняя оценка последствий применения той или иной медицинской технологии может дать объективный ответ о её пользе для системы здравоохранения и экономики государства в целом.
Заключение / Conclusion
Таким образом, по результатам приведённого систематического обзора данных литературы можно сформулировать основные аспекты негативного влияния ИВРЗ на пациентов и систему здравоохранения, а также некоторые пути снижения влияния данного бремени:
- наличие ревматической патологии способствует увеличению риска летальности более, чем в два раза — SMR2,02 [ 1,79; 2,29] по сравнению с общей популяцией; данная тенденция сохраняется и для основных нозологий: для РА — 44 %, для ПсА — 26 %, для аксСпА — 59 % (SMR 1,44 [ 1,32; 1,56]; 1,26 [ 1,08; 1,47]; 1,59 [ 1,29; 1,96] соответственно);
- ожидаемая продолжительность жизни сокращается: при РА на 1,63 года, при аксСпА — на 2,7 лет;
- показано, что при некоторых ИВРЗ увеличивается риск сердечно-сосудистой смертности на 50 % (SMRдля РА 1,50 [ 1,39; 1,61]);
- в структуре смертности при РА самостоятельным фактором риска является активность заболевания: каждые 10 мг/мл СРБ увеличивают риск смерти на 9 % (ОР (HR) 1,09 [ 1,01; 1,18]), каждый балл HAQ— на 53 % (ОР (HR) 1,53 [ 1,06; 2,20]), каждый балл по ВАШ — на 39 % (ОР (HR) 1,39 [ 1,20; 1,60]);
- курение увеличивает риск смерти при РА более, чем в 2 раза (ОР (HR) 2,39 [ 1,31; 4,38]);
- использование ГИБП в терапии ИВРЗ снижает риск летальности пациентов от любой причины на 48 % по сравнению с отсутствием ГИБП в схемах лечения больных (ОР (HR) 0,52 [ 0,32; 0,86]), и на 23 % по сравнению с метотрексатом (ОР (HR) 0,77 [ 0,60; 0,97]) при РА;
- показано, что более ранее назначение ГИБП значимо улучшает выживаемость при РА: показано снижение риска смерти на 16 % (ОР (HR) 0,84 [ 0,77; 0,92]);
- применение ГИБП у пациентов с ИВРЗ снижает риск наступления «больших» ССС на 54 % по сравнению с отсутствием биологической терапии (ОР (RR) 0,46 [ 0,28; 0,77]);
- показано позитивное влияние ГИБП на снижение риска наступления отдельных видов ССС при РА (ИМ и ИИ) на 19 % и 31 % по сравнению с отсутствием применения ГИБП (ОР (RR) для ИМ 0,81 [ 0,68; 0,96], для ИИ 0,69 [ 0,53; 0,89] соответственно);
- использование ГИБП способствует снижению риска наступлении деменции у пациентов с РА на 24 % по сравнению с применением базисных противовоспалительных препаратов (ОР (RR) 0,76 [ 0,72; 0,80]).
Результаты данного исследования могут быть полезны врачам-ревматологам и организаторам здравоохранения для принятия эффективных управленческих решений по оказанию специализированной медицинской помощи пациентам с ревматической патологией.
Список литературы
1. Муравьев ЮВ. Внесуставные проявления ревматоидного артрита. Научно-практическая ревматология. 2018;56(3):356–362. doi: 10.14412/1995-4484-2018-356-362.
2. Насонов ЕЛ. Достижения ревматологии в XXI в. Научно-практическая ревматология. 2014;52(2):133–140. doi: 10.14412/1995-4484-2014-133-140.
3. Насонов ЕЛ. Прогресс ревматологии в начале XXI века. Современная ревматология. 2014;(3): 4–8. doi: 10.14412/1996-7012-2014-3-4-8.
4. Hsieh PH, Wu O, Geue C, McIntosh E, McInnes IB, Siebert S. Economic burden of rheumatoid arthritis : a systematic review of literature in biologic era. Ann Rheum Dis. 2020 Jun;79(6):771-777. doi: 10.1136/annrheumdis-2019-216243.
5. Sokka T, Kautiainen H, Möttönen T, Hannonen P. Work disability in rheumatoid arthritis 10 years after the diagnosis. J Rheumatol. 1999 Aug;26(8):1681-5.
6. Kłak A, Raciborski F, Samel-Kowalik P. Social implications of rheumatic diseases. Reumatologia. 2016;54(2):73-8. doi: 10.5114/reum.2016.60216.
7. Tomek D et al. Understanding Patients’ Socio-Economic Burden in Rheumatic Diseases. Value in Health, Volume 18, Issue 7, A651 - A652.
8. Fyrand L, Moum T, Finset A, Glennås A. The impact of disability and disease duration on social support of women with rheumatoid arthritis. J Behav Med. 2002 Jun;25(3):251-68. doi: 10.1023/a:1015380711375.
9. Галушко ЕА, Насонов ЕЛ. Распространенность ревматических заболеваний в России. Альманах клинической медицины. 2018;46(1):32-39. doi: 10.18786/2072-0505-2018-46-1-32-39.
10. Rodriguez-Rodriguez L, Leon L, Ivorra-Cortes J, Gómez A, Lamas JR, Pato E, Jover JÁ, Abásolo L. Treatment in rheumatoid arthritis and mortality risk in clinical practice: the role of biologic agents. Clin Exp Rheumatol. 2016 Nov-Dec;34(6):1026-1032.
11. Jacobsson LT, Turesson C, Nilsson JA, Petersson IF, Lindqvist E, Saxne T, Geborek P. Treatment with TNF blockers and mortality risk in patients with rheumatoid arthritis. Ann Rheum Dis. 2007 May;66(5):670-5. doi: 10.1136/ard.2006.062497.
12. Aviña-Zubieta JA, Choi HK, Sadatsafavi M, Etminan M, Esdaile JM, Lacaille D. Risk of cardiovascular mortality in patients with rheumatoid arthritis: a meta-analysis of observational studies. Arthritis Rheum. 2008 Dec 15;59(12):1690-7. doi: 10.1002/art.24092.
13. Ward MM. Interpreting studies of cardiovascular mortality in rheumatoid arthritis: the importance of timing. Arthritis Rheum. 2008 Dec 15;59(12):1687-9. doi: 10.1002/art.24170.
14. Peters MJ, van Halm VP, Voskuyl AE, Smulders YM, Boers M, Lems WF, Visser M, Stehouwer CD, Dekker JM, Nijpels G, Heine R, Dijkmans BA, Nurmohamed MT. Does rheumatoid arthritis equal diabetes mellitus as an independent risk factor for cardiovascular disease? A prospective study. Arthritis Rheum. 2009 Nov 15;61(11):1571-9. doi: 10.1002/art.24836.
15. Hippisley-Cox J, Coupland CAC, Bafadhel M, Russell REK, Sheikh A, Brindle P, Channon KM. Development and validation of a new algorithm for improved cardiovascular risk prediction. Nat Med. 2024 May;30(5):1440-1447. doi: 10.1038/s41591-024-02905-y.
16. Zegkos T, Kitas G, Dimitroulas T. Cardiovascular risk in rheumatoid arthritis: assessment, management and next steps. Ther Adv Musculoskelet Dis. 2016 Jun;8(3):86-101. doi: 10.1177/1759720X16643340.
17. van Nies JA, de Jong Z, van der Helm-van Mil AH, Knevel R, Le Cessie S, Huizinga TW. Improved treatment strategies reduce the increased mortality risk in early RA patients. Rheumatology (Oxford). 2010 Nov;49(11):2210-6. doi: 10.1093/rheumatology/keq250.
18. Barnabe C, Martin BJ, Ghali WA. Systematic review and meta-analysis: anti-tumor necrosis factor α therapy and cardiovascular events in rheumatoid arthritis. Arthritis Care Res (Hoboken). 2011 Apr;63(4):522-9. doi: 10.1002/acr.20371.
19. Listing J, Kekow J, Manger B, Burmester GR, Pattloch D, Zink A, Strangfeld A. Mortality in rheumatoid arthritis: the impact of disease activity, treatment with glucocorticoids, TNFα inhibitors and rituximab. Ann Rheum Dis. 2015 Feb;74(2): 415-21. doi: 10.1136/annrheumdis-2013-204021.
20. Xie W, Hou Y, Xiao S, Zhang X, Zhang Z. Association between disease-modifying antirheumatic drugs for rheumatoid arthritis and risk of incident dementia : a systematic review with meta-analysis. RMD Open. 2024 Feb 27;10(1):e004016. doi: 10.1136/rmdopen-2023-004016.
21. England BR, Sayles H, Michaud K, Caplan L, Davis LA, Cannon GW, Sauer BC, Solow EB, Reimold AM, Kerr GS, Schwab P, Baker JF, Mikuls TR. Cause-Specific Mortality in Male US Veterans With Rheumatoid Arthritis. Arthritis Care Res (Hoboken). 2016 Jan;68(1):36-45. doi: 10.1002/acr.22642.
22. Nomeir AM, Turner R, Watts E, Smith D, West G, Edmonds J. Cardiac involvement in rheumatoid arthritis. Ann Intern Med. 1973 Dec;79(6):800-6. doi: 10.7326/0003-4819-79-6-800.
23. van den Hoek J, Boshuizen HC, Roorda LD, Tijhuis GJ, Nurmohamed MT, van den Bos GA, Dekker J. Mortality in patients with rheumatoid arthritis: a 15-year prospective cohort study. Rheumatol Int. 2017 Apr;37(4):487-493. doi: 10.1007/s00296-016-3638-5.
24. Goodson N, Marks J, Lunt M, Symmons D. Cardiovascular admissions and mortality in an inception cohort of patients with rheumatoid arthritis with onset in the 1980s and 1990<sup>s</sup> . Ann Rheum Dis. 2005 Nov;64(11):1595-601. doi: 10.1136/ard.2004.034777.
25. Krishnan E, Lingala VB, Singh G. Declines in mortality from acute myocardial infarction in successive incidence and birth cohorts of patients with rheumatoid arthritis. Circulation. 2004 Sep 28;110(13):1774-9. doi: 10.1161/01.CIR.0000142864.83780.81.
26. Mattey DL, Glossop JR, Nixon NB, Dawes PT. Circulating levels of tumor necrosis factor receptors are highly predictive of mortality in patients with rheumatoid arthritis. Arthritis Rheum. 2007 Dec;56(12):3940-8. doi: 10.1002/art.23075.
27. Sihvonen S, Korpela M, Laippala P, Mustonen J, Pasternack A. Death rates and causes of death in patients with rheumatoid arthritis: a population-based study. Scand J Rheumatol. 2004;33(4):221-7. doi: 10.1080/03009740410005845. Erratum in: Scand J Rheumatol. 2006 Jul-Aug;35(4):332.
28. Humphreys JH, Warner A, Chipping J, Marshall T, Lunt M, Symmons DP, Verstappen SM. Mortality trends in patients with early rheumatoid arthritis over 20 years: results from the Norfolk Arthritis Register. Arthritis Care Res (Hoboken). 2014 Sep;66(9):1296-301. doi: 10.1002/acr.22296. Erratum in: Arthritis Care Res (Hoboken). 2015 Jan;67(1):135.
29. Toledano E, Candelas G, Rosales Z, Martínez Prada C, León L, Abásolo L, Loza E, Carmona L, Tobías A, Jover JÁ. A meta-analysis of mortality in rheumatic diseases. Reumatol Clin. 2012 Nov-Dec;8(6):334-41. doi: 10.1016/j.reuma.2012.05.006.
30. Bournia VK, Fragoulis GE, Mitrou P, Mathioudakis K, Tsolakidis A, Konstantonis G, Vourli G, Paraskevis D, Tektonidou MG, Sfikakis PP. All-cause mortality in systemic rheumatic diseases under treatment compared with the general population, 2015-2019. RMD Open. 2021 Nov;7(3):e001694. doi: 10.1136/rmdopen-2021-001694.
31. Dadonienė J, Charukevič G, Jasionytė G, Staškuvienė K, Miltinienė D. Mortality in Inflammatory Rheumatic Diseases: Lithuanian National Registry Data and Systematic Review. Int J Environ Res Public Health. 2021 Nov 24;18(23):12338. doi: 10.3390/ijerph182312338.
32. Rubio-Rivas M, Royo C, Simeón CP, Corbella X, Fonollosa V. Mortality and survival in systemic sclerosis: systematic review and meta-analysis. Semin Arthritis Rheum. 2014 Oct;44(2):208-19. doi: 10.1016/j.semarthrit.2014.05.010.
33. Meissner Y, Schäfer M, Albrecht K, Kekow J, Zinke S, Tony HP, Strangfeld A. Risk of major adverse cardiovascular events in patients with rheumatoid arthritis treated with conventional synthetic, biologic and targeted synthetic disease-modifying antirheumatic drugs: observational data from the German RABBIT register. RMD Open. 2023 Oct;9(4):e003489. doi: 10.1136/rmdopen-2023-003489.
34. Sánchez-Piedra C, Sueiro-Delgado D, García-González J, Ros-Vilamajo I, Prior-Español A, Moreno-Ramos MJ, Garcia-Magallon B, Calvo-Gutiérrez J, Perez-Vera Y, Martín-Domenech R, Ruiz-Montesino D, Vela-Casasempere P, Expósito L, Sánchez-Alonso F, González-Davila E, Díaz-González F. Changes in the use patterns of bDMARDs in patients with rheumatic diseases over the past 13 years. Sci Rep. 2021 Jul 23;11(1): 15051. doi: 10.1038/s41598-021-94504-x.
Об авторах
А. М. ЛилаРоссия
Александр Михайлович Лила, д. м. н., профессор, член-корр. РАН, директор ФГБНУ, зав. кафедрой
кафедра ревматологии
Москва
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
М. А. Королев
Россия
Максим Александрович Королев, д. м. н.,
профессор, руководитель института
Научно-исследовательский институт клинической и экспериментальной лимфологии
Новосибирск
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
И. Н. Щендригин
Россия
Иван Николаевич Щендригин, к. м. н., главный врач
Ставрополь
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
К. В. Сапожников
Россия
Кирилл Викторович Сапожников, к. м. н.,
преподаватель
кафедра автоматизации управления медицинской службы с военно-медицинской статистикой
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
А. А. Лазарев
Россия
Андрей Анатольевич Лазарев, аспирант 2 курса обучения
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
Н. А. Саблева
Россия
Наталья Александровна Саблева, независи-
мый эксперт исследовательских проектов
Северо-Западный институт управления; Проектный офис
Москва
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
Д. Г. Толкачева
Россия
Дарья Георгиевна Толкачева, независимый эксперт исследовательских проектов
Северо-Западный институт управления; Проектный офис
Москва
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
Рецензия
Для цитирования:
Лила А.М., Королев М.А., Щендригин И.Н., Сапожников К.В., Лазарев А.А., Саблева Н.А., Толкачева Д.Г. Социальная значимость ревматических заболеваний, негативные последствия для системы здравоохранения и пути профилактики. Реальная клиническая практика: данные и доказательства. 2025;5(2):5-15. https://doi.org/10.37489/2782-3784-myrwd-070. EDN: HWOQXK
For citation:
Lila A.M., Korolev M.A., Shchendrigin I.N., Sapozhnikov K.V., Lazarev A.A., Sableva N.A., Tolkacheva D.G. Social significance of rheumatic diseases, negative consequences for the health care system and ways of prevention. Real-World Data & Evidence. 2025;5(2):5-15. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-070. EDN: HWOQXK
JATS XML






























