Перейти к:
Суррогатные конечные точки в анализе экономической эффективности для использования при оценке медицинских технологий
https://doi.org/10.37489/2782-3784-myrwd-071
EDN: ZVVPHM
Аннотация
Анализ экономической целесообразности применения медицинских технологий необходим для принятия рациональных решений в здравоохранении, которые, в свою очередь, способствуют более эффективному распределению ограниченных бюджетных средств и улучшению качества медицинской помощи. Клинико-экономический анализ оценивает соотношение затрат и результатов применения медицинских технологий, что позволяет определить их целесообразность, учитывая влияние на здоровье пациентов, качество услуг и экономические затраты. Один из методов ускоренной оценки экономической эффективности — использование суррогатных конечных точек (СКТ), что позволяет быстрее и безопаснее оценивать новые медицинские технологии. Их использование важно для лиц, принимающих решения в сфере организации здравоохранения, особенно в условиях недостатка данных о долгосрочной эффективности новых технологий. Их применение должно быть обоснованным, с подтверждённой статистической связью между суррогатными и клиническими конечными точками. Недавно был выпущен отчёт, обобщающий актуальные данные по использованию СКТ в анализе экономической эффективности медицинских технологий, что стало основой для данной статьи.
Ключевые слова
Для цитирования:
Бушева Т.И., Касимова А.Р., Колбин А.С., Пшеничников А.Н. Суррогатные конечные точки в анализе экономической эффективности для использования при оценке медицинских технологий. Реальная клиническая практика: данные и доказательства. 2025;5(2):16-27. https://doi.org/10.37489/2782-3784-myrwd-071. EDN: ZVVPHM
For citation:
Busheva T.I., Kasimova A.R., Kolbin A.S., Pshenichnikov A.N. Surrogate endpoints in cost-effectiveness analysis for use in medical technology assessment. Real-World Data & Evidence. 2025;5(2):16-27. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-071. EDN: ZVVPHM
Введение / Introduction
Определение экономической целесообразности применения медицинских технологий необходимо для того, чтобы принимать взвешенные решения в сфере здравоохранения, способствующие более рациональному распределению средств и повышению уровня качества оказываемой медицинской помощи населению. Клинико-экономический анализ представляет собой процесс оценки соотношения затрат и результатов применения медицинской технологии [13]. Он позволяет определить целесообразность применения медицинской технологии. Для проведения клинико-экономического анализа используются показатели влияния метода лечения на здоровье пациентов, на качество оказываемых медицинских услуг и степень экономических затрат.
Существуют множество методологий проведения клинико-экономического анализа [13], самыми распространёнными из них являются четыре основных метода оценки экономической эффективности:
- анализ минимизации затрат;
- анализ «затраты — эффективность» (его разновидностью является анализ «затраты — полезность»);
- «анализ влияния на бюджет»;
- анализ «затраты — выгода».
Анализ минимизации затрат используется в тех случаях, когда сравниваемые медицинские технологии обладают одинаковой клинической эффективностью. В такой ситуации анализируются только затраты на реализацию технологии. На практике эффективность различных вмешательств редко бывает одинаковой, что ограничивает применение данного метода.
Анализ «затраты — эффективность» является самым часто применяемым методом. С его помощью можно определить, насколько велики затраты, требующиеся для достижения дополнительной выгоды при применении конкретного метода лечения. В ходе такого анализа сопоставляются финансовые издержки различных методов лечения, а также воздействие этих методов на здоровье пациентов и систему здравоохранения в целом, что позволяет определить экономическую выгоду от конкретного вида медицинского вмешательства [16]. Данный подход не предназначен для сравнения экономической эффективности методов с различными результатами лечения, также он не учитывает субъективное восприятие пациентом своего состояния. Применение этого метода анализа ограничено только ситуациями, когда важно оценивать комплексные показатели, включая увеличение продолжительности жизни и улучшение её качества.
Анализ «затраты — полезность» дополняет анализ «затраты — эффективность», в отличие от предыдущего метода, использует данные о продолжительности жизни и её качестве. Критериями эффективности в этом анализе могут являться такие показатели, как клинические результаты, частота осложнений, изменения в качестве жизни, приобретённые годы жизни, уровень инвалидизации, летальность и удовлетворённость пациентов проведённым лечением. Для проведения анализа чаще всего используется интегральный показатель QALY (год жизни с поправкой на качество), который отражает изменение продолжительности жизни и её качества в результате проведённого лечения. Результаты этого метода выражаются в стоимости вмешательства на каждый добавленный год жизни с учётом изменения её качества. Одним из основных преимуществ данного анализа является возможность сравнения экономической эффективности различных методов лечения пациентов с различными заболеваниями.
Анализ влияния на бюджет позволяет оценить финансовые последствия от введения новой медицинской технологии с учётом ограниченности ресурсов системы. Этот анализ помогает понять, как в условиях ограниченности ресурсов введение новой технологии повлияет на бюджет конкретного регулятора или организации [13].
Анализ «затраты — выгода» заключается в приведении стоимости лечения и достигнутых результатов к денежным единицам, что упрощает расчёт финансовой выгоды от применения данного метода.
Классические методы проведения фармакоэкономического анализа требуют использования объёмного пула информации, получение которого занимает достаточно много времени. Например, это может быть информация, полученная в результате проведения клинических исследований, анализа реестров фондов, оплачивающих лечение, или исследований реальной клинической практики. Применение ускоренных методов оценки экономической эффективности приобретает всё большую значимость в условиях динамичного и неопределённого рынка, что способствует принятию более обоснованных и своевременных решений. Для этого есть несколько причин:
Быстрые изменения в медицинских технологиях: с развитием технологий, таких как телемедицина, искусственный интеллект и новые методы лечения, необходимо быстро оценивать их экономическую эффективность, чтобы обеспечить доступность и целесообразность внедрения новых решений в клиническую практику.
Ограниченные ресурсы здравоохранения: в условиях ограниченных бюджетов и растущих затрат на здравоохранение важно быстро и эффективно оценивать, какие технологии приносят наибольшую пользу для пациентов и системы здравоохранения в целом. Ускоренные методы оценки помогают оптимизировать распределение ресурсов.
Необходимость быстрой адаптации к изменениям: пандемия COVID-19 продемонстрировала, как быстро могут меняться потребности в здравоохранении. Ускоренные методы оценки позволяют оперативно реагировать на новые вызовы и внедрять эффективные решения.
Регуляторные требования: регуляторные органы, такие как FDA (Food and Drug Administration — Управление по контролю качества пищевых продуктов и лекарственных средств) и EMA (European Medicines Agency — Агентство по оценке лекарственных препаратов на их соответствие требованиям, изложенным в Европейской Фармакопее), требуют от производителей медицинских технологий предоставления данных об их экономической эффективности. Ускоренные методы оценки могут помочь в подготовке необходимых документов и обоснований для получения разрешений.
Увеличение значимости доказательной медицины: в условиях растущего внимания к доказательной медицине и необходимости обоснования клинических решений, ускоренные методы оценки помогают быстро предоставить данные о стоимости и эффективности новых технологий.
Сравнительный анализ технологий: ускоренные методы оценки позволяют быстро сравнивать различные медицинские технологии и подходы, что помогает принимать более обоснованные решения о внедрении и финансировании.
Важнейшим этапом экономических исследований является выбор специфических критериев (конечных точек), которые позволяют оценить эффективность медицинского вмешательства и сделать вывод о целесообразности его применения в клинической практике. При планировании этих точек в исследовательской работе возникают определённые сложности, одна из них заключается в том, что отдалённые результаты не всегда подтверждают выводы об эффективности лечения, основанные на анализе непосредственных клинических эффектов. Например, использование препарата, снижающим артериальное давление, не всегда приводит к снижению риска инсульта и преждевременной смерти, как это было установлено для верапамила [11]. Только при правильном выборе конечных точек оценка эффективности вмешательства будет объективной. При выборе точек клинической эффективности необходимо учитывать такие факторы, как специфика вмешательства, особенности и характер заболевания, а также значимость точки для пациента. Поэтому выбор точек клинической эффективности в клинических и фармакоэкономических исследованиях представляет собой сложную задачу, решение которой необходимо для получения достоверных результатов.
Одним из методов ускорения оценки экономической эффективности является использование суррогатных конечных точек (СКТ), что позволяет быстрее и безопаснее оценивать новые медицинские технологии. К заболеваниям, в которых традиционно используются суррогатные конечные точки, относятся онкологические (например, опухолевый ответ на общую выживаемость) и сердечно-сосудистые заболевания (например, артериальное давление влияет на сердечно-сосудистую смертность или заболеваемость). В клинических областях, где результаты, значимые для пациента, оцениваются относительно быстро (например, дерматология или острые заболевания), потребность в суррогатных конечных показателях значительно меньше.
Использование суррогатных конечных точек в анализе экономической эффективности важно для органов оценки технологий здравоохранения (ОТЗ), особенно в условиях недостатка данных о долгосрочной эффективности новых медицинских технологий.
Их применение должно быть обоснованным [4] и основанным на надёжных данных, подтверждающих связь между суррогатными и клиническими конечными точками. Взаимосвязь между СКТ и конечным результатом должна быть доказана статистическими методами оценки. До сих пор не существовало единого руководства по использованию СКТ для органов оценки технологии здравоохранения. Недавно вышел отчёт [5], который обобщил самые актуальные данные, имеющиеся в литературе (в том числе и существующие рекомендации органов ОТЗ разных стран), посвящённые анализу экономической эффективности медицинских технологий с помощью суррогатных конечных точек. Там же [5] даны рекомендации по созданию единого руководства для ОТЗ для использования СКТ. Данная статья посвящена основным аспектам использования суррогатных точек для оценки клинической и экономической эффективности медицинской технологии.
Цели исследования / Objective
Обобщить и систематизировать опубликованную в открытых источниках информацию, посвящённую использованию суррогатных конечных точек при оценке эффективности медицинских технологий.
Материалы и методы / Materials and methods
В базах данных PubMed (MEDLINE), Elibrary и Киберленинка были проведены поисковые запросы по ключевым словам. Запрос формировался на основе термина «суррогатная конечная точка» и «оценка эффективности медицинской технологии». Также при написании статьи использовался отчёт White paper, подготовленный под руководством Агентства по лекарственным препаратам Канады (CDA-AMC), Института клинических и экономических исследований (ICER) в США, Министерства здравоохранения и ухода за престарелыми Австралии, Национального института здравоохранения (ZIN) в Нидерландах, Института оценки технологий в здравоохранении (IETS) в Колумбии и Rubix Health в США.
В результате поиска за период с 2001 по 2024 гг. были найдены 547 статей, опубликованных на русском и английском языках. После ознакомления с заголовками исключено 520 статей, а после ознакомления с абстрактами — оставлены только исследования, посвящённые непосредственно роли суррогатных точек в фармакоэкономическом анализе. Так же были исключены публикации, в которых суррогатные точки упоминались, как средство оценки эффективности технологии здравоохранения. Таким образом, было выбрано и проанализировано 15 публикаций. Также в ходе написания этой статьи был использован новый отчёт White paper 2025 года [5].
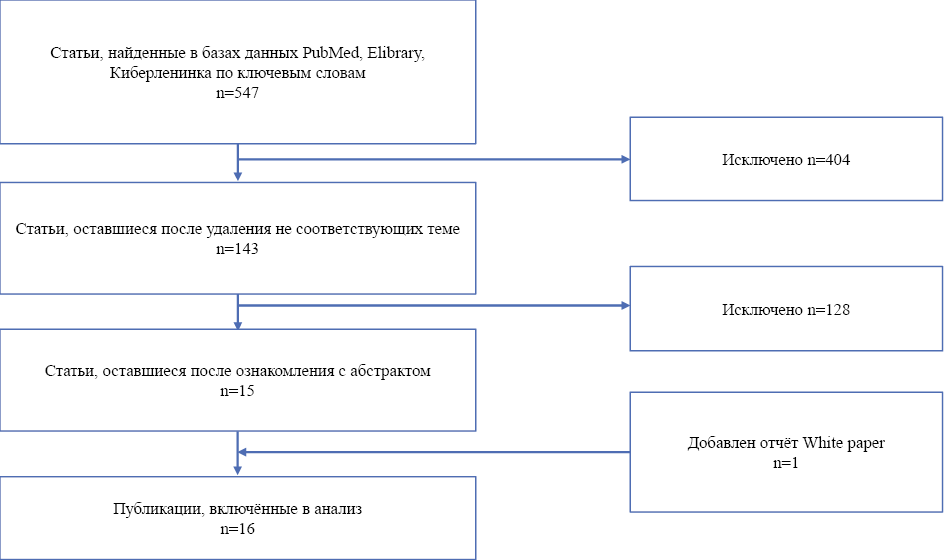
Рис. 1. Последовательность поиска литературных источников и его результаты
Fig. 1. Sequence of literary search and its results
Определения / Definitions
Клинические конечные точки представляют собой измеримые исходы, которые используются для оценки эффективности и безопасности нового лечения или медицинского вмешательства в клинических испытаниях, которые отражают эффект терапевтического вмешательства. Они являются наиболее достоверными характеристиками, используемыми при оценке преимуществ и рисков терапевтического вмешательства в рандомизированных клинических испытаниях [2]. К типам клинических конечных точек относят:
- Основные (жёсткие) конечные точки: основные параметры, которые оценивает исследование, чтобы продемонстрировать эффективность лечения (например, снижение уровня смертности) [11].
- Вторичные (мягкие) конечные точки: дополнительные параметры, которые исследуются, чтобы предоставить более полное понимание эффекта лечения (например, качество жизни пациентов, оцененное с помощью опросников) [11].
- Комбинированные методы: интегральные показатели, такие как число лет жизни с поправкой на её качество (QALY) [12].
Суррогатные конечные точки (или суррогатные конечные показатели) — это индикаторы, которые используются в исследованиях и экспериментах для оценки результатов, когда прямое измерение целевого результата затруднительно или невозможно. Они служат заменой для более сложных или долгосрочных конечных точек, позволяя исследователям получать предварительные данные и делать выводы на основе более доступных и легко измеряемых показателей. Примеры суррогатных конечных точек могут включать:
- Биомаркеры: например, уровень холестерина может использоваться как суррогатная конечная точка для оценки риска сердечно-сосудистых заболеваний.
- Функциональные показатели: в клинических испытаниях лекарств для лечения рака, уменьшение размера опухоли может служить суррогатной конечной точкой.
- Клинические симптомы: уменьшение симптомов заболевания может использоваться как суррогатная конечная точка, если это связано с улучшением общего состояния пациента [1].
По сравнению с клиническими конечными точками суррогатные имеют ряд преимуществ при использовании:
- Ускорение процесса разработки: суррогатные конечные точки позволяют исследователям быстрее оценить эффективность нового лечения. Это может сократить время и стоимость клинических испытаний, поскольку временные промежутки, необходимые для наблюдения за конечными клиническими исходами, могут быть значительными.
- Раннее выявление эффекта: измерение суррогатных конечных точек зачастую позволяет определить, оказывает ли терапия положительное влияние на состояние пациента раньше, чем это могло бы произойти при оценке клинических исходов.
- Этика: в некоторых случаях может быть неэтично или рискованно ждать окончательных клинических исходов (например, при серьёзных болезнях), поэтому использование суррогатных конечных точек позволяет проводить исследования, не подвергая пациентов излишнему риску.
- Поддержка регуляторных решений: суррогатные конечные точки могут использоваться в качестве основы для предварительных одобрений новых препаратов, что позволяет быстрее вводить их на рынок, особенно в условиях необходимости экстренных решений (например, при пандемиях или в случае редких заболеваний).
- Обеспечение информации о механизме действия: суррогатные конечные точки могут помочь в понимании механизма действия препарата, подтверждая предположения о биологической активности до того, как будут получены данные о клинических результатах.
- Отбор пациентов: использование суррогатных конечных точек может помочь в идентификации групп пациентов, которые, получат наибольшую пользу от терапии, что может способствовать более целенаправленному и эффективному лечению.
Нормативные стандарты для проверки суррогатных конечных точек / Regulatory standards for validation of surrogate endpoints
На сайте FDA США [4] опубликован список одобренных суррогатных конечных точек (перечислены нозологические формы и применимые для их оценки СКТ), которые можно использовать для утверждения или лицензирования лекарственных средств. Согласно этому списку, суррогатные конечные точки можно разделить на три категории: «кандидат», «разумно вероятная» и «проверенная». Описание и обобщение данных использования этих категорий представлено в таблице 1.
Там же [4] указаны причины, которые обосновывают использование суррогатных конечных точек для принятия регулирующих решений: во-первых, ситуация когда проведение исследований в сравнении с плацебо неэтично, а прямые результаты, имеющие отношение к пациенту, потребуют длительных исследований; во-вторых, когда использование СКТ ускоряет доступ к перспективным методам лечения нозологических форм, для лечения которых отсутствует зарегистрированный эффективный аналог (когда есть высокая потребность в препаратах).
В отчёте [5] опубликованы основные тезисы и изменения (начиная с 2018 года) в руководствах по использованию суррогатных конечных точек в оценке медицинских технологий. Результаты представлены в таблице 2.
Таблица 1. Конечные точки и их роль в принятии регуляторных решений [4] Table 1. Endpoints and their role in regulatory decision making [4] | ||
Категория суррогатной конечной точки | Основные характеристики суррогатной конечной точки | Пример суррогатной конечной точки |
«Кандидат» | Существует механистическая связь между СКТ и клинической конечной точкой, но недостаточно эпидемиологических (или рандомизированных) данных для установления корреляции между ними. | Баллы по шкале оценки депрессии, баллы по шкале оценки боли (могут использоваться в исследованиях, направленных на улучшение качества жизни). |
«Разумно вероятная» | Сильное механистическое или эпидемиологическое обоснование может указывать на корреляцию между суррогатной и клинической конечной точкой, предназначенной для оценки клинической пользы, однако недостаточно клинических данных для подтверждения суррогатной конечной точки. Решения о разумных суррогатных конечных точках принимаются в обсуждениях между FDA и спонсором, что может привести к ускоренному одобрению лекарств и медицинских устройств. При этом требуются пострегистрационные испытания для подтверждения ожидаемого эффекта на заболеваемость или смертность. | Уровень воспалительных маркеров (такие как С-реактивный белок или интерлейкин-6. Такие показатели имеют патофизиологическую связь с результатами лечения). |
«Проверенная» | Сочетает в себе чёткое механистическое обоснование и данные рандомизированных клинических исследований, которые доказывают, что воздействие на суррогатную конечную точку предсказывает воздействие на клинический исход, представляющий основной интерес. Проверенные суррогатные конечные точки могут использоваться в качестве основы для регулярного одобрения медицинского продукта без необходимости проведения дополнительных исследований для подтверждения клинической пользы. | Гликированный гемоглобин (были проведены рандомизированный клинические исследования, в которых доказана прямая зависимость уровня гликированного гемоглобина и таких осложнений как диабетическая ретинопатия, нефропатия, нейропатия). |
Таблица 2. Имеющиеся тезисы, опубликованные в руководствах ОТЗ по использованию суррогатных конечных точек [5] Table 2. Available abstracts published in HTA guidelines on the use of surrogate endpoints [5] | |
Тезисы | Основные положения |
Общие вопросы и определения | · Клиническая конечная точка — наилучший показатель эффективности. · Если окончательный результат недоступен, можно использовать суррогатную конечную точку. · Если используется СКТ, её следует проверить. · Использование суррогатных конечных точек (проверенных или непроверенных) обязательно должно быть обосновано, а их валидность должна быть оценена. · Если нет окончательных результатов и нет проверенного суррогата конечные точки, то некоторые органы ОТЗ допускают использование непроверенных СКТ на стадии моделирования исследовании (в таком случает требуется согласование с органами ОТЗ). Но непроверенная суррогатная конечная точка не может быть принята в качестве доказательства дополнительной пользы вмешательства. |
Определение суррогатной конечной точки | Отсутствует ясность в определении суррогатных конечных точек. Существует необходимость в стандартизированном подходе для решения этого вопроса. |
Распространённость использования СКТ | Наблюдается общее увеличение использования суррогатных конечных точек. |
Сила доказательств | Существуют 3 уровня силы доказательств [6][12]: · Уровень 1: доказательства, демонстрирующие, что влияние лечения на суррогатную конечную точку соответствуют влиянию на клинический результат; включает метаанализ нескольких рандомизированных контролируемых испытаний, который демонстрирует, что изменения СКТ соразмерны изменениям в конечных результатах. · Уровень 2: доказательства, демонстрирующие устойчивую связь между суррогатной конечной точкой и конечным клиническим результатом подтверждены только данными интервенционных, эпидемиологических или наблюдательных исследований. · Уровень 3: только доказательства биологической правдоподобности связи между суррогатной конечной точкой и конечным результатом (например данные патофизиологических исследований). Предпочтение должно быть отдано уровню 1, однако в некоторых случаях (например, при вмешательствах в отношении редких заболеваний) могут быть приемлемы и более низкие уровни доказательств. |
Проверка суррогатных конечных точек | Процесс валидации основан на уровнях силы доказательств и состоит из 3 этапов: 1. Установление биологической правдоподобности (уровень 3). 2. Оценка корреляции между суррогатной конечной точкой и окончательным результатом (уровень 2). 3. Оценка связи между эффектом лечения в суррогате и эффектом на окончательный результат (уровень 1). Даже при отсутствии высокой корреляции можно делать выводы о ценности суррогатной конечной точки, учитывая пороговый эффект, определяемый как минимальный эффект, который предсказывает клинический результат. |
Экстраполяция данных | Перенос валидности СКТ из других исследований возможен при соблюдении однородности следующих факторов [7]: · вмешательства и механизм действия; · популяция, на которую рассчитано исследование; · обстановка, в которой собираются данные; · заболевание и стадия заболевания у испытуемых. Если валидированные исследования доступны только в разных условиях, руководства предлагают рассмотреть возможность разработки новой статистической модели валидации в аналогичном контексте. Если валидационное исследование включает различные нозологические единицы или вмешательства, то оно должно включать оценку гетерогенности. |
Требования к отчётности | Данные, которые должны присутствовать в отчёте [7]: · конечный результат, который заменяет суррогатная конечная точка; · обоснование использования суррогатной конечной точки; · биологическое или клиническое обоснование связи между суррогатной конечной точкой и конечным результатом; · валидация суррогатной конечной точки (уровень доказательств ассоциации; сила ассоциации; уверенность в ассоциации); · соответствие исследований, используемых при валидации, популяции, вмешательству (механизму действия) и заболеванию, рассматриваемому в представлении; · значения корреляции приняты между 0,85 и 0,95. |
Использование суррогатных конечных точек при экономическом моделировании | Неопределённость, вызванная взаимосвязью между суррогатными конечными точками и конечными результатами, должна быть количественно оценена и представлена в дополнение к исследованию с помощью анализа сценариев и вероятностного анализа чувствительности. При использовании предлагаемой суррогатной конечной точки в экономической оценке её необходимо преобразовать в конечный результат. |
Руководство для разработчиков технологий по использованию СКТ для принятия решений | Большинство органов ОТЗ имеют ограниченные рекомендации по управлению суррогатными конечными точками в своих методических руководствах. Необходимо создать более подробные рекомендации по оценке клинической эффективности на основе суррогатных конечных точек и для её перевода в оценку стоимости эффективность. |
Оценка неопределённости, возникающей из-за использования суррогатных конечных точек | Степень неопределённости определяется такими подходами, как: проведение анализа сценариев (наилучшие и наихудшие значения для СКТ), полное удаление суррогатной конечной точки из модели и использование принятого конечного результата; ценность анализа информации. |
Статистические методы проверки суррогатных конечных точек / Statistical methods for testing surrogate endpoints
В отчёте [5] приведён обзор литературы (статей и руководящих документов), посвящённых статистическим методам оценки суррогатных конечных точек. Авторами отчёта выявлены критерии для определения хорошей суррогатной точки (такой тип СКТ, у которой доказана её взаимосвязь с конечным результатом и её можно использовать как результат клинических исследований) на основе статистических измерений, но нет единого мнения по их применению. При проверке суррогатных конечных точек важно учитывать контекст, особенно при использовании методов для множественных испытаний, так как различия между ними (например, клинические характеристики пациентов, механизм действия лечения, продолжительность наблюдения) могут влиять на результаты. Методы для множественных испытаний лучше применять в условиях крупных высококачественных рандомизированных клинических исследований, оценивающих одно и то же лечение в одном контексте, но такие данные редко доступны.
К наиболее используемым статистическим методам проверки СКТ по данным рандомизированный клинических исследований относятся:
- Критерии Прентиса — модельный критерий, который гарантирует, что взаимосвязь между лечением и суррогатной конечной точкой является действительной.
- Доля объяснённого эффекта лечения — количественно определяет взаимосвязь, которая основана на соотношении двух оценок эффекта лечения на конечный результат с поправкой на суррогатную конечную точку и без неё.
- Мета-аналитический подход, мета-регрессия — количественно определяет взаимосвязь на основе средней предсказанной ошибки. Меньшие значения средней предсказанной ошибки предсказанного эффекта по сравнению с клинически значимым эффектом лечения на конечный результат подтверждают обоснованность суррогатной конечной точки.
- Мета-аналитический подход, относительные эффекты — рассматривается расширение метода мета-регрессии с одним испытанием для оценки на основе относительного эффекта. Альтернативная мера оценки — объём информации о клиническом результате с учётом суррогатной конечной точки. Суррогатный пороговый эффект — мера, разработанная для оценки силы суррогата, измеряющая минимальное значение эффекта лечения на суррогатную конечную точку, при котором прогнозируемый эффект на конечный результат будет статистически значимо отличаться от нуля.
- Информационно-теоретический подход — количественно определяет связь с помощью значения, которое интерпретируется как доля неопределённости в конечном результате на индивидуальном уровне, которая устраняется путём корректировки на суррогатную конечную точку.
- Эффект лечения оценивается относительно общего эффекта — является суммой естественного косвенного эффекта и естественного прямого эффекта на результат, обусловленный исключительно лечением.
- Относительный эффект и скорректированная связь — количественно определяет взаимосвязь с помощью относительного эффекта, который можно интерпретировать как наклон регрессии лечения по конечному результату против эффекта лечения на суррогатную конечную точку.
- Непараметрический подход — основывается на оценке суррогата на основе оптимизации среднеквадратической ошибки. Этот подход количественно оценил силу взаимосвязи, вычислив долю общего эффекта лечения, объяснённую суррогатной конечной точкой.
Преимущества и недостатки, а также условия использования этих методов приведены в таблице 3 [8].
Таблица 3. Методы статистической проверки суррогатных конечных точек Table 3. Methods for statistical testing of surrogate endpoints | |||
Название метода | Преимущества | Недостатки | Условия использования |
Критерии Прентиса | · Не требуются сложные вычисления · Достоверность · Широкая применимость · Лёгкость интерпретации | · Неколичественный метод · Не учитывает структуру выборки | Требуется большая выборка |
Доля объяснённого эффекта лечения | Лёгкость интерпретации данных | Не учитывает качество данных | Требуется большая выборка |
Мета-аналитический подход, мета-регрессия | · Высокая достоверность · Позволяет обобщать данные разных исследований (используют гетерогенные данные) · Помогает выявить области, где недостаточно данных или где необходимы дополнительные исследования | · Сложность анализа · Зависимость от качества данных | Требуются множественные испытания одного и того же метода лечения с тем же пациентом и заданной клиническим результатом. Подход был адаптирован как для непрерывных, так и для бинарных рядов |
Мета-аналитический подход, относительные эффекты | · Высокая достоверность · Позволяет обобщать данные разных исследований (используют гетерогенные данные) · Помогает выявить области, где недостаточно данных или где необходимы дополнительные исследования | · Сложность анализа · Зависимость от качества данных | Необходимость множественных испытаний одного и того же лечения с использованием одной и той же суррогатной точки и конечного результата для точной оценки эффекта лечения |
Название метода | Преимущества | Недостатки | Условия использования |
Информационно-теоретический подход | · Структурированность · Универсальность · Высокая достоверность | · Сложность анализа · Зависимость от качества данных | Требуются множественные испытания одного и того же метода лечения с одним и тем же пациентом и конечным результатом |
Относительный эффект и скорректированная связь | · Высокая достоверность · Позволяет провести анализ взаимосвязи данных | · Сложность метода · Зависимость от полученных данных — риск систематической ошибки | Используется при непрерывном измерении суррогатного конечного результата |
Непараметрический подход | · Возможность использования различных типов данных · Простота метода | · Низкая достоверность · Сложность интерпретации полученных данных · Ограниченная мощность метода | Подходит для анализа различных данных, полученных в разнообразных условиях |
Таким образом, можно сделать вывод, что при работе с суррогатными конечными точками в клинических исследованиях важно применять методы статистической оценки, которые учитывают условия проведения исследований. Выбор метода использования статистической оценки суррогатной конечной точки зависит от нескольких ключевых факторов [12]:
- Цель исследования:определение основной цели исследования влияет на выбор метода статистической оценки данных, полученных в результате этого исследования. Например, для оценки эффективности лечения или безопасности лучше всего подходят непараметрический подход, оценка естественных косвенных эффектов и мета-аналитический подход.
- Тип данных:на выбор метода оценки данных влияет их тип, например, непрерывные оцениваются с помощью мета-аналитических методов, бинарные оцениваются с помощью критериев Прентиса или непараметрического подхода.
- Свойства суррогатной конечной точки:важно учитывать, насколько суррогатная конечная точка надёжно предсказывает исходные конечные точки. Это может потребовать предварительного анализа и валидации.
- Структура выборки:размер и состав выборки влияют на выбор метода. Например, для малых выборок могут быть предпочтительнее непараметрические методы, что является исключением для использования методов метаанализа.
- Статистические предположения:разные методы имеют свои предположения (например, нормальность распределения, однородность дисперсий), и важно убедиться, что данные соответствуют этим предположениям.
- Этичные и практические аспекты:важно учитывать этические соображения, а также практические аспекты, такие как доступность данных и ресурсы для анализа.
Выбор метода зависит от конкретных данных и целей исследования. Важно помнить, что суррогатные конечные точки должны быть валидированы, чтобы обеспечить надёжность выводов.
Рекомендации / Recommendations
Будущие единые рекомендации должны быть гибкими: необходима возможность применять их к различным ситуациям, в которых могут встречаться суррогатные конечные точки; и последовательными как в рамках органов ОТЗ (например, их можно использовать для различных типов оценки), так и между органами ОТЗ. Так же рекомендации должны обладать рядом качеств, которые отражены в сводной таблице 4.
Таблица 4. Рекомендации для разработчиков медицинских технологий [5] Table 4. Recommendations for developers of medical technologies [5] | |
Рекомендации | Пояснения |
Выбирайте соответствующие клинические конечные точки | Используйте общепринятые и надёжные клинические конечные точки, если они доступны. Если существуют клинические показатели для оценки влияния вмешательств на течение заболевания в интересующем состоянии, то их следует включить в качестве конечных точек в исследование, даже если мерой оценки выбраны суррогатные конечные точки. |
Взаимодействуйте с регулирующими органами и органами ОТЗ на раннем этапе | Взаимодействие на раннем этапе (планирование исследования) обеспечит соответствие выбранных результатов и запланированного статистического анализа ожиданиям этих органов. |
Рекомендации | Пояснения |
Представьте протокол и результаты исследования согласно действующим нормативам | Для создания протоколов следует использовать норматив SPIRIT-Surrogate [14] (SPIRIT — рекомендации для интервенционных испытаний. Руководство по созданию протоколов, основанное на консенсусе, предназначенное для протоколов испытаний, использующих СКТ в качестве основного результата). Для создания отчётов о результатах испытаний следует использовать CONSORT-Surrogate [15] (CONSORT — сводные стандарты испытаний отчётности. Руководство по отчётности, основанное на консенсусе, для испытаний с использованием суррогатных конечных точек в качестве основных результатов). |
Выбор подходящей структуры модели заболевания | |
Постройте модель, отражающую течение заболевания и ключевые клинические события | Модель не должна строиться вокруг суррогатной или промежуточной конечной точки. |
Выберите модель, которая определяется целью исследования | Структура модели не должна определяться исключительно доступностью данных. |
Необходимо учитывать предыдущие соответствующие экономические анализы | Предыдущие анализы могут быть использованы, их следует использовать только, если это улучшит качество модели заболевания. |
Выбор конечных результатов для экономической модели | |
Выберите подходящий конечный результат для базового экономического анализа | Если имеются данные о принятом конечном результате, их следует использовать в базовом анализе экономической эффективности. |
Обоснуйте выбор суррогатной конечной точки | Выбор суррогатной конечной точки должен быть обоснован и надлежащим образом и проверен [4]. |
Проверка суррогатной конечной точки | |
Установите достоверность суррогатной конечной точки | Используете поэтапный подход, основанный на трёх уровнях, указанных в таблице 2 [7]. |
Используйте соответствующий подход к статистической проверке. | Количественно оцените связь СКТ и конечного результата, используя соответствующий статистический подход, отмечая соображения, базовые предположения и ограничения каждого подхода. |
Получите экспертную проверку суррогатной конечной точки | Мнение клинических экспертов о достоверности суррогатной конечной точки как предиктора окончательных результатов. |
Стандарты проверки суррогатных конечных точек | Необходимо больше рекомендаций для проверки СКТ: · стандартизация использования статистических методов для оценки связи между СКТ и конечным результатом на индивидуальном уровне и уровне исследования; · руководство по валидации данных; · руководство по представлению данных; · данные клинической значимости суррогатной конечной точки. |
Отчётность | Необходимо полностью описывать подход к проведению оценки взаимоотношений СКТ и конечного результата. Требуется прозрачная отчётность о том, как они используют доказательства из суррогатной конечной точки, как они были проверены и как это может повлиять на результаты. Это также может включать процедуру моделирования, предположения, выполненные анализы чувствительности, а также их ограничения и сильные стороны. |
База данных суррогатных конечных точек | Создание «живой библиотеки» суррогатных конечных точек и их доступных доказательств, будет полезна для совместного использование органами ОТЗ наряду с руководящим документом. |
Ориентированность | Необходимо, чтобы руководство учитывало то, что наиболее важно для пациентов, и то насколько значимым является цель, достигнутая при использовании СКТ. |
Выводы / Conclusions
Суррогатные конечные точки всё чаще применяются для оценки и создания технологий здравоохранения. Важно иметь чёткие рекомендации по их использованию при оценке клинической и экономической эффективности медицинских технологий. Рекомендации должны освещать все этапы использования СКТ: от планирования клинических испытаний до оценки их результатов [9]. Необходимо точно определить условия использования СКТ, статистические критерии достоверности СКТ, а также создать единую базу с результатами исследований с использованием СКТ. Данный обзор подтвердил важность создания единого нормативного документа для работы с СКТ.
Список литературы
1. De Gruttola VG, Clax P, DeMets DL, Downing GJ, Ellenberg SS, Friedman L, et al. Considerations in the evaluation of surrogate endpoints in clinical trials: summary of a National Institutes of Health workshop. Contemp Clin Trials. 2001;22(5):485–502.
2. Biomarkers Definitions Working Group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther. 2001 Mar;69(3):89-95. doi: 10.1067/mcp.2001.113989.
3. Yule MS, Thompson J, Leesahatsawat K, Sousa MS, Anker SD, Arends J, Balstad TR, Brown LR, Bye A, Dajani O, Fallon M, Hjermstad MJ, Jakobsen G, McDonald J, McGovern J, Roeland EJ, Sayers J, Skipworth RJE, Ottestad IO, Philips I, Simpson MR, Solheim TS, Vagnildhaug OM, McMillan D, Laird BJA, Dolan RD; Cancer Cachexia Endpoints Working Group. Biomarker endpoints in cancer cachexia clinical trials : Systematic Review 5 of the cachexia endpoint series. J Cachexia Sarcopenia Muscle. 2024 Jun;15(3):853-867. doi: 10.1002/jcsm.13491.
4. Table of Surrogate Endpoints That Were the Basis of Drug Approval or Licensure Режим доступа: https://www.fda.gov/drugs/development-resources/table-surrogate-endpoints-were-basis-drug-ap-proval-or-licensure
5. Canada’s Drug Agency (CDA-AMC), previously the Canadian Agency for Drugs and Technologies in Health (CADTH); the Institute for Clinical and Economic Review (ICER) in the US; the Australian Department of Health and Aged Care; the National Health Care Institute (ZIN) in the Netherlands; the Institute for Technology Assessment in Health (IETS) in Colombia; Rubix Health in the US. White paper. Surrogate endpoints in cost-effectiveness analysis for use in health technology assessment
6. Kaltenthaler E, Brazier J, De Nigris E, Tumur I, Ferriter M, Beverley C, Parry G, Rooney G, Sutcliffe P. Computerised cognitive behaviour therapy for depression and anxiety update : a systematic review and economic evaluation. Health Technol Assess. 2006 Sep;10(33):iii, xi-xiv, 1-168. doi: 10.3310/hta10330.
7. Ciani O, Buyse M, Drummond M, Rasi G, Saad ED, Taylor RS. Time to Review the Role of Surrogate End Points in Health Policy: State of the Art and the Way Forward. Value Health. 2017 Mar;20(3):487-495. doi: 10.1016/j.jval.2016.10.011.
8. Elston J, Taylor RS. Use of surrogate outcomes in cost-effectiveness models : A review of United Kingdom health technology assessment reports. International Journal of Technology Assessment in Health Care. 2009;25(1):6-13. doi:10.1017/S0266462309090023
9. Bujkiewicz S, Achana F, Papanikos T, Riley R, & Abrams K. (2019). NICE DSU Technical Support Document 20: Multivariate meta-analysis of summary data for combining treatment effects on correlated outcomes and evaluating surrogate endpoints. Режим доступа: https://www.sheffield.ac.uk/nice-dsu/tsds/multivariate-meta-analysis
10. Moynihan R. Surrogates under scrutiny: fallible correlations, fatal consequences. BMJ. 2011 Aug 15;343:d5160. doi: 10.1136/bmj.d5160.
11. Ягудина Р. И., Чибиляев В. А. Использование конечных и суррогатных точек в фармакоэкономических исследованиях. Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология. 2010;2:12-18.
12. Лазебник Л. Б., Гусеин-заде М. Г., Ефремов Л. И. Выбор «Суррогатных» и «Конечных точек» в оценке эффективности медицинских вмешательств. Экспериментальная и клиническая гастроэнтерология. 2011;8:73-79.
13. Гуркина МВ, Сметанина НС, Румянцев АГ. Экономические методы оценки эффективности медицинских технологий в гематологии. Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2018;17(2):136-143. doi: 10.24287/1726-1708-2018-17-2-136-143
14. Manyara AM, Davies P, Stewart D, Weir CJ, Young AE, Blazeby J, Butcher NJ, Bujkiewicz S, Chan AW, Dawoud D, Offringa M, Ouwens M, Hróbjartsson A, Amstutz A, Bertolaccini L, Bruno VD, Devane D, Faria CDCM, Gilbert PB, Harris R, Lassere M, Marinelli L, Markham S, Powers JH 3rd, Rezaei Y, Richert L, Schwendicke F, Tereshchenko LG, Thoma A, Turan A, Worrall A, Christensen R, Collins GS, Ross JS, Taylor RS, Ciani O. Reporting of surrogate endpoints in randomised controlled trial protocols (SPIRIT-Surrogate): extension checklist with explanation and elaboration. BMJ. 2024 Jul 9;386:e078525. doi: 10.1136/bmj-2023-078525.
15. Manyara AM, Davies P, Stewart D, Weir CJ, Young AE, Blazeby J, Butcher NJ, Bujkiewicz S, Chan AW, Dawoud D, Offringa M, Ouwens M, Hróbjartsson A, Amstutz A, Bertolaccini L, Bruno VD, Devane D, Faria CDCM, Gilbert PB, Harris R, Lassere M, Marinelli L, Markham S, Powers JH 3rd, Rezaei Y, Richert L, Schwendicke F, Tereshchenko LG, Thoma A, Turan A, Worrall A, Christensen R, Collins GS, Ross JS, Taylor RS, Ciani O. Reporting of surrogate endpoints in randomised controlled trial reports (CONSORT-Surrogate): extension checklist with explanation and elaboration. BMJ. 2024 Jul 9;386:e078524. doi: 10.1136/bmj-2023-078524.
Об авторах
Т. И. БушеваРоссия
Татьяна Игоревна Бушева, ординатор
кафедра клинической фармакологи и доказательной медицины
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
А. Р. Касимова
Россия
Алина Рашидовна Касимова, к. м. н., доцент, врач — клинический фармаколог
кафедра клинической фармакологии и доказательной медицины; отделение клинической фармакологии
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
А. С. Колбин
Россия
Алексей Сергеевич Колбин, д. м. н., профессор, зав. кафедрой
кафедра клинической фармакологии и доказательной медицины
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
А. Н. Пшеничников
Россия
Александр Николаевич Пшеничников, врач-терапевт
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
Рецензия
Для цитирования:
Бушева Т.И., Касимова А.Р., Колбин А.С., Пшеничников А.Н. Суррогатные конечные точки в анализе экономической эффективности для использования при оценке медицинских технологий. Реальная клиническая практика: данные и доказательства. 2025;5(2):16-27. https://doi.org/10.37489/2782-3784-myrwd-071. EDN: ZVVPHM
For citation:
Busheva T.I., Kasimova A.R., Kolbin A.S., Pshenichnikov A.N. Surrogate endpoints in cost-effectiveness analysis for use in medical technology assessment. Real-World Data & Evidence. 2025;5(2):16-27. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-071. EDN: ZVVPHM
JATS XML






























