Перейти к:
Синтез доказательств в заболеваниях спектра оптиконевромиелита: моделирование клинического исследования на основании опубликованных данных
https://doi.org/10.37489/2782-3784-myrwd-072
EDN: VDZMKX
Аннотация
Актуальность. Заболевания спектра оптиконевромиелита – тяжёлая орфанная нозология, для которой поиск новых высокоэффективных терапевтических опций является приоритетным направлением медицинской помощи. Вместе с тем, в связи с характером данной группы заболеваний, проведение новых клинических исследований (КИ) существенно затруднено с точки зрения не только длительного и сложного набора пациентов и неэтичности использования параллельной контрольной группы без лечения, но и проведения сравнений с исторической контрольной группой или непрямых сравнений, для которых планирование объема выборки в КИ для новой опции терапии является отдельной методологической задачей.
Целью настоящего исследования явилась оценка мощности для анализа первичной конечной точки в одногрупповом КИ BCD-132-6/AQUARELLE, который планировалось провести с помощью скорректированного непрямого сравнения (СНС) исследуемого препарата дивозилимаб с опубликованными данными по плацебо-группе в рандомизированном КИ N-MOmentum.
Материалы и методы. По данным исследований, отобранным с помощью систематического поиска, была оценена метарегрессионная модель для зависимости среднегодовой частоты обострений (СЧО) от терапии (анти-CD20 или плацебо), горизонта оценки и исходных характеристик пациентов. По её результатам для ожидаемой популяции BCD-132-6/AQUARELLE для терапии анти-CD20 была предсказана 6-месячная СЧО 0,116 (95 % ДИ: 0,030–0,212). Далее было проведено симуляционное моделирование СНС с пошаговым увеличением эффективного размера выборки (ЭРВ) в группе дивозилимаба с оценкой мощности.
Результаты. Ожидаемое отношение СЧО дивозилимаба и плацебо за 6 месяцев составило 0,117 (90 % ДИ: 0,045–0,214) без взвешивания и 0,156 (90 % ДИ: 0,050–0,315) после взвешивания (СНС). Минимальный ЭРВ, необходимый для достижения мощности 90 % при проверке гипотезы превосходства по СЧО за 6 мес. на терапии дивозилимабом по сравнению с плацебо с односторонней вероятностью ошибки I рода 0,05 оставляет 35 человек.
Заключение. Полученные результаты могут быть использованы для подкрепления статистического вывода исследования BCD-132-6/AQUARELLE.
Ключевые слова
Для цитирования:
Толкачева Д.Г., Фатеев И.В., Сапожников К.В., Мироненко О.Н., Лазарев А.А., Баторова В.Д., Порозова А.А., Зинкина-Орихан А.В. Синтез доказательств в заболеваниях спектра оптиконевромиелита: моделирование клинического исследования на основании опубликованных данных. Реальная клиническая практика: данные и доказательства. 2025;5(2):28-39. https://doi.org/10.37489/2782-3784-myrwd-072. EDN: VDZMKX
For citation:
Tolkacheva D.G., Fateev I.V., Sapozhnikov K.V., Mironenko O.N., Lazarev A.A., Batorova V.D., Porozova A.A., Zinkina-Orikhan A.V. Evidence synthesis in neuromyelitis optica spectrum disorders: modeling a clinical trial based on published data. Real-World Data & Evidence. 2025;5(2):28-39. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-072. EDN: VDZMKX
Введение / Introduction
Заболевания спектра оптиконевромиелита (ЗСОНМ) — группа тяжёлой аутоиммунной демиелинизирующей патологии центральной нервной системы, относящейся к классу орфанных заболеваний с распространённостью от 0,45 до 5 случаев на 100 тыс. населения. Клиническая картина ЗСОНМ характеризуется быстрым прогрессированием инвалидизации: у 50 % пациентов необратимая потеря зрения и/или стойкие двигательные (парезы) и чувствительные нарушения возникают в течение 5 лет после дебюта. Наличие тяжёлых и инвалидизирующих обострений с преимущественным поражением спинного мозга и зрительных нервов отличает ЗСОНМ от рассеянного склероза и обусловливает существенное социальное бремя — до 30 % пациентов теряют трудоспособность в первые 3 года болезни [1-4].
Разработка и оценка клинической эффективности новых терапевтических опций при орфанных нозологиях представляет собой сложный и дорогостоящий процесс, в связи с чем проведение клинического исследования (КИ), не показавшего статистической значимости в анализе первичной конечной точки (ПКТ), может иметь значительные последствия даже для крупных фармацевтических компаний [5]. Одной из ключевых проблем является малое количество подходящих под критерии включения пациентов [6], в том числе для набора параллельной контрольной группы, что значительно усложняет процесс принятия решения о старте исследования. Отсутствие параллельной контрольной группы не является непреодолимым барьером для исследовательской команды, поскольку в её распоряжении имеется метод безъякорных скорректированных непрямых сравнений (СНС) [7], однако оценка ожидаемой статистической мощности в данном случае представляет собой сложную задачу. Решением может быть проведение симуляционного моделирования, в ходе которого оценивается мощность при различных значениях эффективного размера выборки (ЭРВ), например, от 10 до 100 % от планового значения.
Для корректного моделирования необходимо располагать информацией о характеристиках целевой популяции и ожидаемой эффективности исследуемого препарата. Если данные о пациентах могут быть собраны из регистров или на этапе скрининга, то ожидаемая эффективность препарата часто основывается на экспертном мнении, поскольку отсутствуют надёжные количественные оценки.
Получение математически обоснованной оценки эффективности препарата возможно двумя способами:
- разработка модели «экспозиция — ответ» (Exposure-Response model), основанной на данных доклинических испытаний на животных и их экстраполяции на человека;
- разработка популяционной модели на основе опубликованных данных.
Последний подход, особенно при наличии информации об эффективности препаратов с аналогичным механизмом действия, представляется наиболее реалистичным и был успешно применён в работе Zierhut M. L. и соавт. [8].
Исследование препаратов для терапии ЗСОНМ является показательным примером использования популяционных моделей, разработанных на основе опубликованных данных, для оценки статистической мощности ПКТ. В частности, на текущий момент проводится КИ BCD-132-6/AQUARELLE, в котором для оценки ПКТ запланировано проведение СНС без якоря между моноклональным антителом анти-CD20 — дивозилимабом и плацебо-группой исследования N-MOmentum [9]. Целью данного анализа стало моделирование и оценка статистической мощности для анализа ПКТ: отношение среднегодовых частот обострений (СЧО) на терапии дивозилимабом по данным исследования BCD-132-6/AQUARELLE по сравнению с плацебо в исследовании N-MOmentum за 6 месяцев наблюдения.
По данным систематического обзора и метаанализа, проведённого Aungsumart S. et al. [10], среди терапевтических опций ЗСОНМ выделяют ряд современных препаратов: инебилизумаб [9][11], сатрализумаб [12][13], ритуксимаб [14][15], экулизу- маб [16] и тоцилизумаб [17]. Наличие опубликованных внешних данных позволяет провести симуляционное моделирование на их базе.
Материалы и методы / Materials and methods
В рамках поставленной задачи исследования анализ данных проводился в несколько этапов:
- Оценка метарегрессионной модели для зависимости СЧО от терапии (анти-CD20 или плацебо), горизонта оценки СЧО и исходных характеристик популяции исследования по данным публикаций ранее проведённых КИ. На основе полученной модели было выполнено прогнозирование СЧО за 6 месяцев для терапии анти-CD20 в популяции исследования BCD-132-6/AQUARELLE.
- Расчёт индивидуальных весовых коэффициентов для пациентов BCD-132-6/AQUARELLE в зависимости от их исходных характеристик и средних значений этих характеристик в группе плацебо в исследовании N-MOmentum для последующего СНС.
- Для оценки статистической мощности проведено итеративное симуляционное моделирование с использованием метода СНС. На каждом цикле симуляций количество обострений за 6 месяцев для каждого пациента в исследовании BCD-132-6/AQUARELLE генерировалось случайным образом из распределения Пуассона со средним значением, полученным в п. 1. Симуляции проводились при постепенном увеличении эффективного размера выборки (ЭРВ) от 10 до 100 % от планового числа пациентов, чтобы определить минимальный порог ЭРВ для достижения мощности не менее 90 % для анализа ПКТ. В связи с орфанным характером заболевания проверка гипотезы превосходства дивозилимаба по сравнению с плацебо (без порога) проводилась с односторонним уровнем значимости 0,05 (5 %).
Метарегрессия является инструментом метаанализа, используемым для описания гетерогенности, а также оценки взаимосвязи различных переменных, отражающих исходные характеристики популяции исследования или особенностей дизайнов КИ, с размером эффекта. Последнее в отсутствие прямых сравнений позволяет выявить возможные категории пациентов, для которых преимущества от данного вмешательства могут быть наибольшими [18][19].
В рамках настоящего исследования оценена метарегрессионная модель для зависимости СЧО от горизонта оценки СЧО (в месяцах), терапии (активный компаратор или плацебо) и следующими исходными характеристиками пациентов в каждом рукаве (максимальный перечень с учётом доступности данных во всех включённых в метарегрессию исследованиях):
- доля женщин;
- доля AQP4-позитивных пациентов;
- доля субъектов негроидной расы.
Эффекты всех объясняющих переменных оценивались как фиксированные.
Данный анализ проводился в среде R версии 4.4.1 с помощью пакета metafor v. 4.2–0 [20].
По результатам метарегрессионной модели было рассчитано предсказанное значение СЧО за 6 месяцев при терапии моноклональным антителом анти-CD20 (активный компаратор) для популяции BCD-132-6/AQUARELLE при известных на момент анализа значениях описательных статистик перечисленных выше исходных характеристик пациентов.
На момент анализа в исследование BCD-132-6/AQUARELLE было набрано 74 человека при планируемом итоговом количестве участников 105. Для целей моделирования было дополнительно отобрано 25 человек из числа скринфэйлеров (прошедшим скрининг, но не включённым в исследование по причинам, не связанным с основным заболеванием) или включённых в исследование, но ещё не получивших первую дозу дивозилимаба на момент старта. Таким образом, дальнейшее симуляционное моделирование выполнялось по данным для 99 человек с известными исходными характеристиками, которые либо начали получать дивозилимаб в исследовании BCD-132-6/AQUARELLE, либо могли бы его получить при полном соответствии критериям включения и невключения в BCD-132-6/AQUARELLE. Это было сделано для того, чтобы объём выборки максимально соответствовал запланированному и при этом у нас были бы данные по исходным характеристикам реальных пациентов, без необходимости генерации подобных данных с дополнительными допущениями о совместном распределении этих характеристик.
В ходе дальнейшего симуляционного моделирования проводилось СНС СЧО в смоделированной популяции BCD-132-6/AQUARELLE в сравнении с опубликованными данными по плацебо в исследовании N-MOmentum. СНС проводилось без якоря ввиду отсутствия общего компаратора.
Методология СНС соответствовала рекомендациям NICE TSD 18 [7] и включала оценку относительного эффекта (ОСЧО), скорректированного на показатели исходного статуса пациентов, к числу которых в СНС без якоря принято относить модификаторы эффекта (изменяют относительный эффект сравниваемых препаратов) и прогнозные переменные (влияют на исход). Некоторые из них могут быть переменными комбинированного влияния (одновременно прогнозной переменной и модификатором эффекта). Схематично классификация различных показателей исходного статуса по ролям в системе оценки эффекта воздействия на исход представлена на рис. 1.
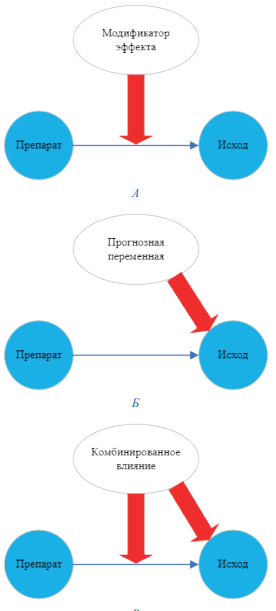
Рис. 1. Виды вмешивающихся переменных, которые следует учитывать при скорректированных непрямых сравнениях
Fig. 1. Types of confounding variables to consider in adjusted indirect comparisons
СНС проводилось в соответствии с планом статистического анализа (SAP) для BCD-132-6/AQUARELLE. Выравнивание (взвешивание) популяции BCD-132-6/AQUARELLE проводилось по следующим исходным характеристикам популяции группы плацебо из N-MOmentum:
- средний возраст пациентов;
- доля женщин;
- доля AQP4-позитивных пациентов;
- доля субъектов азиатской расы;
- средний балл EDSS;
- доля пациентов с небиологической терапией в анамнезе;
- доля пациентов с биологической терапией в анамнезе.
По данным 99 пациентов, включённых в анализ, сформирован датасет, содержащий индивидуальные данные пациентов по исходным характеристикам (пол, возраст, раса, статус AQP4, балл EDSS, наличие небиологической терапии в анамнезе, наличие биологической терапии в анамнезе). Небиологической терапией считались: азатиоприн, микофеноловая кислота, микофенолата мофетил, терифлуномид, метотрексат, митоксантрон. Биологической терапией считались: ритуксимаб, экулизумаб, сатрализумаб, инебилизумаб, интерферон бета-1a/1b, препарат исследования, глатирамера ацетат.
Пропущенные значения исходных характеристик некоторых пациентов в BCD-132-6/AQUARELLE, с учётом их небольшого количества, были заполнены согласно методу множественного восполнения с использованием цепных уравнений (MICE) при допущении об условно случайном характере этих пропусков (англ. missing at random; MAR).
Коррекция оценки эффекта в рамках СНС основана на взвешивании. Веса для пациентов в группе компаратора (плацебо из N-MOmentum) принимаются равными 1, а для пациентов на исследуемом препарате (дивозилимаб из BCD-132-6/ AQUARELLE) рассчитываются с помощью метода моментов [7] таким образом, чтобы взвешенные средние значения показателей исходного статуса пациентов из BCD-132-6/AQUARELLE были максимально близки к соответствующим средним значениям в популяции пациентов из исследования N-MOmentum. Чем больше вес, тем сильнее пациент из исследования BCD-132-6/AQUARELLE похож на пациентов из популяции исследования N-MOmentum. Схематично процесс взвешивания представлен на рис. 2.
По полученным значениям весов рассчитывается ЭРВ для исследуемого препарата — он соответствует количеству пациентов, которое позволило бы без взвешивания получить оценку эффекта с такой же точностью, как у взвешенной оценки. Чем ЭРВ ближе к исходному размеру выборки, тем более сопоставимыми являются популяции групп сравнения по показателям исходного статуса до коррекции и тем выше будет статистическая мощность при проверке гипотезы для эффекта по сравнению с компаратором. Рассчитанное значение ЭРВ округлялось до ближайшего меньшего целого числа.
Для прогнозирования скорректированной СЧО и скорректированного ОСЧО за 6 мес. при терапии дивозилимабом в BCD-132-6/AQUARELLE в сравнении с группой плацебо из исследования N-MOmentum и оценки минимального ЭРВ для обеспечения 90 % мощности при проверке гипотезы в отношении ПКТ использовалось симуляционное моделирование. Для группы плацебо N-MOmentum взяты данные из статьи [9] (см. табл. 1), СЧО рассчитывалось как отношение числа событий за 6 мес. к числу пациенто-лет наблюдения за 6 мес.
Таблица 1. Выгруженные данные для расчёта СЧО компаратора Table 1. Downloaded data for calculating the comparator's SCR | ||||
Исследование | Компаратор | Число подтверждённых обострений | Срок наблюдения (пациенто-лет) | СЧО (95 % ДИ) |
N-MOmentum | Плацебо | 22 | 21,8 | 1,01 (0,79–1,23) |
Для прогнозирования скорректированной СЧО и скорректированного ОСЧО за 6 мес. при терапии дивозилимабом в BCD-132-6/AQUARELLE по сравнению с группой плацебо из исследования N-MOmentum проводилось 10 тыс. симуляций, в каждой из которых:
А.1. Для 99 чел. в группе дивозилимаба формировалась случайная выборка количества обострений за 6 мес. из распределения Пуассона со средним значением, равным половине СЧО за 6 мес., предсказанным для популяции BCD-132-6/AQUARELLE с помощью метарегрессионной модели.
А.2. Оценивалась СЧО за 6 мес. в группе дивозилимаба без взвешивания.
А.3. Оценивалась скорректированная СЧО за 6 мес. в группе дивозилимаба (взвешенная СЧО с индивидуальными весами, полученными в соответствии с методологией, описанной выше).
А.4. Оценивалось ОСЧО за 6 мес. в группе дивозилимаба по сравнению с группой плацебо N-MOmentum без взвешивания с 90 % ДИ.
А.5. Оценивалось скорректированное ОСЧО за 6 мес. в группе дивозилимаба по сравнению с группой плацебо N-MOmentum в соответствии с методологией СНС, описанной выше.
А.6. Оценивался 90 % ДИ для ОСЧО из п. А. 5. методом mesially shrunk logit Вальда [21], описанным в SAP.
В качестве оценки ожидаемой СЧО за 6 мес. при терапии дивозилимабом без и с коррекцией представлено среднее значение соответствующих СЧО, полученных в 10 тыс. симуляций с 95 % квантильным ДИ.
В качестве оценки ожидаемого ОСЧО за 6 мес. при терапии дивозилимабом в BCD-132-6/AQUARELLE по сравнению с плацебо из исследования N-MOmentum без и с коррекцией представлено среднее значение соответствующих ОСЧО, полученных в 10 тыс. симуляций с 95 % квантильным ДИ.
Дополнительно оценена ожидаемая мощность проверки гипотезы для ПКТ с помощью наивного сравнения и СНС без якоря по данным 99 пациентов — как доля симуляций, в которых верхняя граница 90 % ДИ для ОСЧО без коррекции и с коррекцией, соответственно, была меньше 1 (нулевая гипотеза была отклонена на одностороннем уровне значимости 5 %).
Для оценки минимального ЭРВ, обеспечивающего мощность 90 % при проверке гипотезы в отношении ПКТ, проводилось симуляционное моделирование для каждого из вариантов ЭРВ от 10 до 90 чел. с шагом в 5 чел. (n). Для этого в рамках каждой из 10 тыс. симуляций, описанных выше:
В. 1. Делалась случайная выборка n наблюдений для количества обострений за 6 мес. из распределения Пуассона со средним значением, равным СЧО за 6 мес., полученным в п. A. 3. выше.
В. 2. Оценивалась СЧО за 6 мес. по данным из B. 1. с расчётом стандартной ошибки.
В. 3. Оценивалось скорректированное ОСЧО за 6 мес. в группе дивозилимаба по сравнению с плацебо N-MOmentum как отношение СЧО, полученного в B. 2., к СЧО за 6 мес. по данным плацебо в N-MOmentum.
В. 4. Рассчитывался 90 % ДИ для скорректированного ОСЧО за 6 мес., исходя из асимптотически нормального распределения для логарифма оценки ОСЧО и стандартной ошибки, рассчитанной как квадратный корень из суммы квадратов стандартных ошибок для логарифма СЧО в каждой группе.
Мощность для каждого варианта ЭРВ рассчитывалась как процент симуляций, в которых верхняя граница 90 % ДИ для скорректированного ОСЧО в группе дивозилимаба по сравнению с плацебо была меньше единицы (нулевая гипотеза для ПКТ была отклонена на одностороннем уровне значимости 5 %).
В процессе моделирования были приняты следующие допущения:
- Значение СЧО на терапии анти-CD20 моноклональными антителами, включая дивозилимаб, у пациентов с ЗСОНМ является фиксированным (не является случайной величиной), при данных средних характеристиках популяции пациентов (доля женщин, средний возраст, доля AQP4-позитивных пациентов, доля субъектов негроидной расы). То есть при данных значениях этих характеристик различия в СЧО между разными анти-CD20 моноклональными антителами у пациентов с ЗСОНМ являются случайными и объясняются только выборочной вариацией.
- Количество обострений у одного пациента подчиняется распределению Пуассона, при этом количество обострений за 6 мес. составит половину количества обострений за 1 год.
- Все пациенты в рамках исследования BCD-132-6/AQUARELLE наблюдаются в течение 6 мес. каждый, т. е. обострения после 6 мес. терапии дивозилимабом в оценке СЧО и ОСЧО за 6 мес. не учитываются.
- Пропуски по исходным характеристикам пациентов BCD-132-6/AQUARELLE, использованным для расчёта весов для СНС, являются условно случайными (MAR).
- Отсутствуют ненаблюдаемые или неизмеренные предикторы СЧО и модификаторы эффекта дивозилимаба по сравнению с плацебо в отношении СЧО при оценке весов для СНС, помимо использованных для коррекции (пол, возраст, раса, AQP4 статус, EDSS, небиологическая и биологическая терапия в анамнезе).
- ЭРВ для ПКТ исследования BCD-132-6/ AQUARELLE составит не менее 61,6 % от запланированного числа пациентов (n=105), то есть не менее 65 пациентов. Это означает, что пациенты, включённые в анализ ПКТ, должны быть, в среднем, достаточно схожи по характеристикам, использованным для взвешивания, как с выборкой из 99 чел., на основе которой проводилось моделирование, так и с популяцией из N-MOmentum.
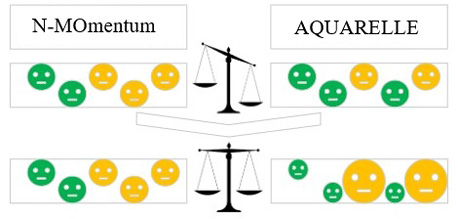
Рис. 2. Схема взвешивания при скорректированном непрямом сравнении
Fig. 2. Weighting scheme for adjusted indirect comparison
Таблица 2. Оценки параметров метарегрессии (со стандартными ошибками) Table 2. Meta-regression parameter estimates (with standard errors) | |
Параметр | Оценка (станд. ош.) |
Intercept | 1,57 |
(1,62) | |
Активный компаратор | –1,38*** |
(0,11) | |
Длительность наблюдения (месяцы) | –1,08*** |
(0,08) | |
% негроидной расы | 8,49*** |
(2,35) | |
% AQP4 позитивных пациентов | –3,41*** |
(0,67) | |
% женщин | 3,12 |
(2,03) | |
Критерий Акаике | 14,4 |
Статистика I2 | 0,0 |
Примечания: + p <0,1; * p <0,05; ** p <0,01; *** p <0,001 | |
Результаты и обсуждение / Results and discussion
Оценки параметров метарегрессионной модели представлены в таблице 2. Уровень остаточной гетерогенности в модели (I2) равен 0. Знаки коэффициентов, отражающие ассоциацию переменных с СЧО, соответствуют ожиданиям, основанным на патогенетических особенностях заболевания.
Предсказанные СЧО для разных горизонтов оценки представлены на рис. 3, за 6 месяцев ожидаемая СЧО составила 0,11 (95 % предсказательный интервал 0,05–0,22).
Несомненно, математико-статистический аппарат — качественный и высокоточный инструмент в руках исследователя, однако разработанная любая модель нуждается в валидации в реальных условиях. Финальный этап оценки качества предсказаний будет проведён по итогам получения результатов ПКТ КИ BCD-132-6/AQUARELLE.
Результаты взвешивания популяции пациентов BCD-132-6/AQUARELLE (99 человек) по агрегированным характеристикам популяции пациентов исследования N-MOmentum (56 человек), представлены в таблице 3. Значения взвешенных описательных статистик совпадают со значениями целевой популяции.
ЭРВ для BCD-132-6/AQUARELLE составил 61 человек (61,6 % от исходного размера выборки).
Ожидаемые значения СЧО за 6 мес. на терапии дивозилимабом без коррекции и с коррекцией, полученные по результатам 10 тыс. симуляций, представлены в таблице 4, ОСЧО за 6 мес. для сравнения между группами дивозилимаба из BCD-132-6/AQUARELLE и плацебо из N-MOmentum — в табл. 5 и на рис. 4.
Результаты анализа мощности проверки гипотезы для ПКТ в BCD-132-6/AQUARELLE по данным 10 тыс. симуляций для разных значений ЭРВ представлены на рис. 5. Минимальный ЭРВ, при котором достигается мощность 90 %, составляет 35 пациентов (35,4 % от 99 чел., включённых в анализ).
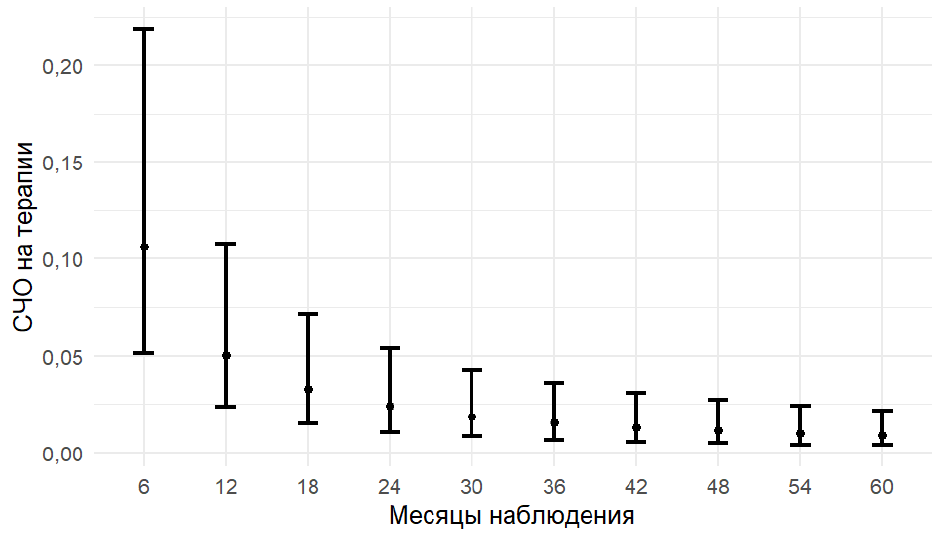
Рис. 3. Предсказанные СЧО по месяцам наблюдения c 95 % предсказательным интервалом
Fig. 3. Predicted ARR by months of observation with 95 % predictive interval
Таблица 3. Сравнение средних значений по исходным характеристикам пациентов BCD-132-6/AQUARELLE (дивозилимаб) и N-MOmentum (плацебо) Table 3. Comparison of mean values for baseline patient characteristics between BCD-132-6/AQUARELLE (divozilimab) and N-MOmentum (placebo) | |||||
Переменная | Целевое значение (N-MOmentum) | Исходное значение BCD-132-6/AQUARELLE | Разница нескорр. | Взвешенное значение BCD-132-6/AQUARELLE | Разница скорр. |
Возраст | 42,6 | 44,6 | 2,0 | 42,6 | –0,0 |
Доля субъектов женского пола | 89,3 % | 79,8 % | –9,5 % | 89,3 % | 0,0 % |
Доля субъектов монголоидной расы | 14,3 % | 6,1 % | –8,2 % | 14,3 % | –0,0 % |
Доля серопозитивных по наличию антител к AQP4 | 92,9 % | 87,9 % | –5,0 % | 92,9 % | –0,0 % |
EDSS | 4,2 | 4,2 | 0,002 | 4,2 | –0,0 |
Небиологическая терапия в анамнезе | 46,4 % | 28,3 % | –18,1 % | 46,4 % | 0,0 % |
Биологическая терапия в анамнезе | 8,9 % | 16,2 % | 7,2 % | 8,9 % | 0,0 % |
Таблица 4. Предсказанные значения среднегодовой частоты обострений в популяции BCD-132-6/AQUARELLE (дивозилимаб) Table 4. Predicted values of average annual relapse rate in the BCD-132-6/AQUARELLE (divozilimab) population | |
Точка оценки | СЧО за 6 мес. (95 % ДИ) |
Без коррекции | 0,116 (0,030; 0,212) |
С коррекцией (взвешенная по характеристикам популяции плацебо из КИ N-MOmentum) | 0,155 (0,042; 0,335) |
Таблица 5. Предсказанные значения отношения среднегодовых частот обострений на терапии дивозилимабом (BCD-132-6/AQUARELLE) по сравнению с плацебо (N-MOmentum) Table 5. Predicted values of the ratio of annualized relapse rates with divozilimab (BCD-132-6/AQUARELLE) therapy compared with placebo (N-MOmentum) | |||
Коррекция | ОСЧО (90 % ДИ) | ЭРВ | Мощность |
До взвешивания | 0,117 (0,045; 0,214) | 99 | 99,99 % |
После взвешивания | 0,156 (0,050; 0,315) | 61 | 99,49 % |
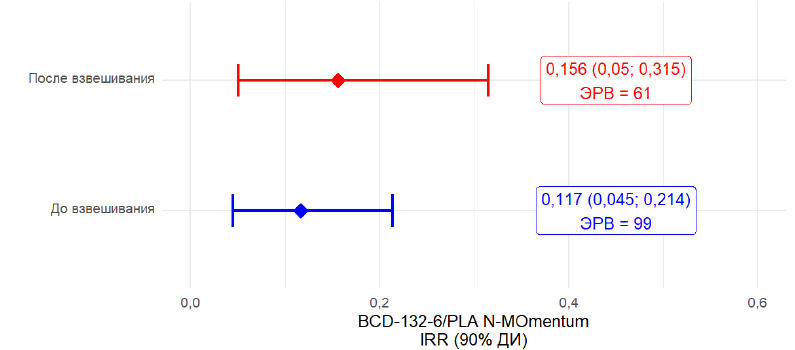
Рис. 4. Предсказанные значения отношения среднегодовых частот обострений на терапии дивозилимабом (BCD-132-6/AQUARELLE) по сравнению с плацебо (N-MOmentum). IRR — ОСЧО
Fig. 4. Predicted values of the ratio of the average annualized rates of relapses with divozilimab therapy (BCD-132-6/AQUARELLE) compared with placebo (N-MOmentum). IRR — ARR
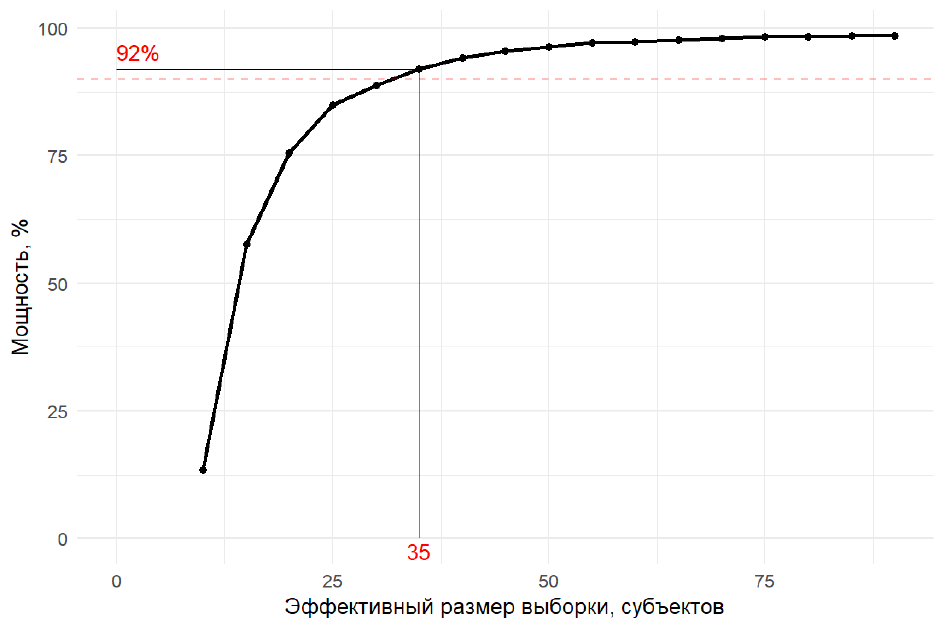
Рис. 5. Результаты анализа мощности
Fig. 5. Power analysis results
Примечания: красная пунктирная линия — порог 90 % мощности; шрифтом красного цвета отмечен минимальный ЭРВ (35 человек), который обеспечивает мощность выше порога (92 %).
Notes: The red dotted line is the 90 % power threshold; the minimum ERV (35 people) that provides power above the threshold (92 %) is marked in red font.
Заключение / Conclusion
Результаты симуляционного моделирования показали, что ожидаемая СЧО за 6 мес. на терапии дивозилимабом составляет 0,116 (95 % ДИ: 0,030–0,212) без коррекции на различия между популяциями BCD-132-6/AQUARELLE и группы плацебо в исследовании N-MOmentum и 0,155 (95 % ДИ: 0,042–0,335) после коррекции с помощью СНС. ЭРВ по данным для 99 пациентов в группе дивозилимаба, включённых в анализ в рамках настоящего исследования, составил 61 чел.
По результатам моделирования ожидаемое ОСЧО за 6 мес. в группе дивозилимаба по сравнению с плацебо составило 0,117 (90 % ДИ: 0,045–0,214) без взвешивания и 0,156 (90 % ДИ: 0,050–0,315) после коррекции.
Минимальный ЭРВ, необходимый для достижения мощности 90 % при проверке гипотезы превосходства по СЧО за 6 мес. на терапии дивозилимабом по сравнению с плацебо с односторонней вероятностью ошибки I рода 0,05 (95 %) составляет 35 человек.
Полученные результаты могут быть использованы для подкрепления статистического вывода исследования BCD-132-6/AQUARELLE.
Список литературы
1. Bruscolini A, Sacchetti M, La Cava M, Gharbiya M, Ralli M, Lambiase A, De Virgilio A, Greco A. Diagnosis and management of neuromyelitis optica spectrum disorders - An update. Autoimmun Rev. 2018 Mar;17(3):195-200. doi: 10.1016/j.autrev.2018.01.001.
2. Whittam D, Wilson M, Hamid S, Keir G, Bhojak M, Jacob A. What's new in neuromyelitis optica? A short review for the clinical neurologist. J Neurol. 2017 Nov;264(11):2330-2344. doi: 10.1007/s00415-017-8445-8.
3. Papp V, Magyari M, Aktas O, Berger T, Broadley SA, Cabre P, Jacob A, Kira JI, Leite MI, Marignier R, Miyamoto K, Palace J, Saiz A, Sepulveda M, Sveinsson O, Illes Z. Worldwide Incidence and Prevalence of Neuromyelitis Optica : A Systematic Review. Neurology. 2021 Jan 12;96(2):59-77. doi: 10.1212/WNL.0000000000011153.
4. Симанив Т.О., Кочергин И.А., Захарова М.Н., Коробко Д.С., Заславский Л.Г., Зеленова О.В., Абрамов С.И. Клинико-эпидемиологические аспекты заболеваний спектра оптиконейромиелита в российской популяции. Журнал неврологии и психиатрии им. С.С. Корсакова. 2021;121(7):96-103. doi: 10.17116/jnevro202112107196.
5. Jayasundara K, Hollis A, Krahn M, Mamdani M, Hoch JS, Grootendorst P. Estimating the clinical cost of drug development for orphan versus non-orphan drugs. Orphanet J Rare Dis. 2019 Jan 10;14(1):12. doi: 10.1186/s13023-018-0990-4.
6. Friede T, Posch M, Zohar S, Alberti C, Benda N, Comets E, Day S, Dmitrienko A, Graf A, Günhan BK, Hee SW, Lentz F, Madan J, Miller F, Ondra T, Pearce M, Röver C, Toumazi A, Unkel S, Ursino M, Wassmer G, Stallard N. Recent advances in methodology for clinical trials in small populations: the InSPiRe project. Orphanet J Rare Dis. 2018 Oct 25;13(1):186. doi: 10.1186/s13023-018-0919-y.
7. Phillippo DM, Ades AE, Dias S, Palmer S, Abrams KR, Welton NJ. Methods for Population-Adjusted Indirect Comparisons in Health Technology Appraisal. Med Decis Making. 2018 Feb; 38(2):200-211. doi: 10.1177/0272989X17725740.
8. Zierhut ML, Chen Y, Pithavala YK, Nickens DJ, Valota O, Amantea MA. Clinical Trial Simulations From a Model-Based Meta-Analysis of Studies in Patients With Advanced Hepatocellular Carcinoma Receiving Antiangiogenic Therapy. CPT Pharmacometrics Syst Pharmacol. 2016 May;5(5):274-82. doi: 10.1002/psp4.12078.
9. Bennett JL, Aktas O, Rees WA, Smith MA, Gunsior M, Yan L, She D, Cimbora D, Pittock SJ, Weinshenker BG, Paul F, Marignier R, Wingerchuk D, Cutter G, Green A, Hartung HP, Kim HJ, Fujihara K, Levy M, Katz E, Cree BAC; N-MOmentum study investigators. Association between B-cell depletion and attack risk in neuromyelitis optica spectrum disorder: An exploratory analysis from N-MOmentum, a double-blind, randomised, placebo-controlled, multicentre phase 2/3 trial. EBioMedicine. 2022 Dec;86:104321. doi: 10.1016/j.ebiom.2022.104321.
10. Aungsumart S, Youngkong S, Dejthevaporn C, Chaikledkaew U, Thadanipon K, Tansawet A, Khieukhajee J, Attia J, McKay GJ, Thakkinstian A. Efficacy and safety of monoclonal antibody therapy in patients with neuromyelitis optica spectrum disorder : A systematic review and network meta-analysis. Front Neurol. 2023 Apr 4;14:1166490. doi: 10.3389/fneur.2023.1166490.
11. Cree BAC, Bennett JL, Kim HJ, Weinshenker BG, Pittock SJ, Wingerchuk DM, Fujihara K, Paul F, Cutter GR, Marignier R, Green AJ, Aktas O, Hartung HP, Lublin FD, Drappa J, Barron G, Madani S, Ratchford JN, She D, Cimbora D, Katz E; N-MOmentum study investigators. Inebilizumab for the treatment of neuromyelitis optica spectrum disorder (N-MOmentum): a double-blind, randomised placebo-controlled phase 2/3 trial. Lancet. 2019 Oct 12;394(10206):1352-1363. doi: 10.1016/S0140-6736(19)31817-3.
12. Traboulsee A, Greenberg BM, Bennett JL, Szczechowski L, Fox E, Shkrobot S, Yamamura T, Terada Y, Kawata Y, Wright P, Gianella-Borradori A, Garren H, Weinshenker BG. Safety and efficacy of satralizumab monotherapy in neuromyelitis optica spectrum disorder: a randomised, double-blind, multicentre, placebo-controlled phase 3 trial. Lancet Neurol. 2020 May;19(5):402-412. doi: 10.1016/S1474-4422(20)30078-8.
13. Yamamura T. et al. Efficacy of satralizumab (SA237) in subgroups of patients in SAkuraSky: a Phase III double-blind, placebo-controlled, addon study in patients with neuromyelitis optica spectrum disorder (NMOSD) (S43.008). Neurology. 2019;15(92):S43.008.
14. Nikoo Z, Badihian S, Shaygannejad V, Asgari N, Ashtari F. Comparison of the efficacy of azathioprine and rituximab in neuromyelitis optica spectrum disorder: a randomized clinical trial. J Neurol. 2017 Sep;264(9):2003-2009. doi: 10.1007/s00415-017-8590-0.
15. Tahara M, Oeda T, Okada K, Kiriyama T, Ochi K, Maruyama H, Fukaura H, Nomura K, Shimizu Y, Mori M, Nakashima I, Misu T, Umemura A, Yamamoto K, Sawada H. Safety and efficacy of rituximab in neuromyelitis optica spectrum disorders (RIN-1 study): a multicentre, randomised, double-blind, placebo-controlled trial. Lancet Neurol. 2020 Apr;19(4):298-306. doi: 10.1016/S1474-4422(20)30066-1.
16. Pittock SJ, Berthele A, Fujihara K, Kim HJ, Levy M, Palace J, Nakashima I, Terzi M, Totolyan N, Viswanathan S, Wang KC, Pace A, Fujita KP, Armstrong R, Wingerchuk DM. Eculizumab in Aquaporin-4-Positive Neuromyelitis Optica Spectrum Disorder. N Engl J Med. 2019 Aug 15;381(7):614-625. doi: 10.1056/NEJMoa1900866.
17. Zhang C, Zhang M, Qiu W, Ma H, Zhang X, Zhu Z, Yang CS, Jia D, Zhang TX, Yuan M, Feng Y, Yang L, Lu W, Yu C, Bennett JL, Shi FD; TANGO Study Investigators. Safety and efficacy of tocilizumab versus azathioprine in highly relapsing neuromyelitis optica spectrum disorder (TANGO): an open-label, multicentre, randomised, phase 2 trial. Lancet Neurol. 2020 May;19(5): 391-401. doi: 10.1016/S1474-4422(20)30070-3.
18. Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, Welch VA (editors). Cochrane Handbook for Systematic Reviews of Interventions. 2<sup>nd</sup> Edition. Chichester (UK): John Wiley & Sons, 2019.
19. Dias S. et al. Heterogeneity: Subgroups, Meta-Regression, Bias And Bias-Adjustment / S. Dias, A. J. Sutton, N. J. Welton, A. E. Ades, London: National Institute for Health and Care Excellence (NICE), 2012.
20. Viechtbauer W. Conducting meta-analyses in R with the metafor package. Journal of Statistical Software. 2010;36(3):1-48. doi: 10.18637/jss.v036.i03
21. Li H. Q., Tang M. L., Wong W. K. Confidence intervals for ratio of two Poisson rates using the method of variance estimates recovery. Computational Statistics. 2014;29:869-889.
Об авторах
Д. Г. ТолкачеваРоссия
Дарья Георгиевна Толкачева, независимый эксперт исследовательских проектов
Северо-Западный институт управления; Проектный офис
Москва
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
И. В. Фатеев
Россия
Иван Владимирович Фатеев, д. м. н., начальник отдела
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
К. В. Сапожников
Россия
Кирилл Викторович Сапожников, к. м. н., преподаватель
кафедра автоматизации управления медицинской службы с военно-медицинской статистикой
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
О. Н. Мироненко
Россия
Ольга Николаевна Мироненко, независимый эксперт исследовательских проектов
Северо-Западный институт управления; Проектный офис
Москва
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
А. А. Лазарев
Россия
Андрей Анатольевич Лазарев, аспирант 2 курса обучения
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
В. Д. Баторова
Россия
Валентина Дмитриевна Баторова, магистр 2 курса обучения
федеральная территория «Сириус»
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
А. А. Порозова
Россия
Анастасия Александровна Порозова, ведущий медицинский эксперт
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
А. В. Зинкина-Орихан
Россия
Арина Валерьевна Зинкина-Орихан, директор департамента
департамент клинической разработки
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов
Рецензия
Для цитирования:
Толкачева Д.Г., Фатеев И.В., Сапожников К.В., Мироненко О.Н., Лазарев А.А., Баторова В.Д., Порозова А.А., Зинкина-Орихан А.В. Синтез доказательств в заболеваниях спектра оптиконевромиелита: моделирование клинического исследования на основании опубликованных данных. Реальная клиническая практика: данные и доказательства. 2025;5(2):28-39. https://doi.org/10.37489/2782-3784-myrwd-072. EDN: VDZMKX
For citation:
Tolkacheva D.G., Fateev I.V., Sapozhnikov K.V., Mironenko O.N., Lazarev A.A., Batorova V.D., Porozova A.A., Zinkina-Orikhan A.V. Evidence synthesis in neuromyelitis optica spectrum disorders: modeling a clinical trial based on published data. Real-World Data & Evidence. 2025;5(2):28-39. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-072. EDN: VDZMKX
JATS XML






























