Перейти к:
СТАТЬЯ ОТОЗВАНА: Исследование ICEDORA: клинико-демографическая характеристика и схемы лечения пациентов с HR+ HER2- местнораспространённым или метастатическим раком молочной железы, принимающих ингибиторы CDK4/6, в реальной клинической практике
https://doi.org/10.37489/2782-3784-myrwd-076
EDN: EFAKGL
Аннотация
Введение. Ингибиторы CDK4/6 в сочетании с эндокринной терапией (ЭТ) являются современным стандартом терапии пациентов с HR+ HER2- распространённым и метастатическим РМЖ (рРМЖ и мРМЖ). Доказательства клинической эффективности ингибиторов CDK4/6 были получены в нескольких рандомизированных клинических исследованиях (РКИ), но данные об их эффективности в условиях реальной клинической практики (РКП) противоречивы.
Целью исследования ICEDORA был анализ клинико-демографических характеристик, схем лечения и клинических исходов у пациентов с HR+ HER2- мрРМЖ и мРМЖ, принимающих ингибиторы CDK4/6 в РКП в Москве.
Материалы и методы. ICEDORA — неинтервенционное ретроспективное исследование, основанное на анализе данных о пациентах, получавших ингибиторы CDK 4/6 в Москве. Из первичной медицинской документации (амбулаторных карт и историй болезни) путём парсинга были извлечены клинические характеристики и подробности лечения всех пациентов с HR+ HER2- РМЖ, принимавших рибоциклиб, палбоциклиб или абемациклиб с января 2020 г. до конца декабря 2022 г. Общую выживаемость (ОВ) рассчитывали от момента выявления РМЖ до смерти пациента с использованием метода Каплана-Мейера, а различия между группами лечения оценивались с помощью логрангового теста. Многофакторные модели логистической регрессии и пропорциональных рисков Кокса были построены с целью исключения влияния вмешивающихся факторов и систематических ошибок.
Результаты. В анализ была включена 2051 пациентка. Палбоциклиб получали 58,7 %, рибоциклиб — 34,7 %, абемациклиб — 6,6 % пациенток. Медиана возраста в общей популяции составила 58 лет, но в группе абемациклиба она была выше (62 года). В 83,5 % случаев Her2/neu был негативным, группы однородны по этому показателю. Уровень рецепторов эстрогена (ER) Ki-67 были значительно выше в группе абемациклиба. В общей популяции пациентки с первично-метастатическим РМЖ (IV стадия) составили 42,1 %. Распределение стадий внутри каждой группы было сопоставимым. По количеству метастазов группы значимо различались за счёт большей доли пациенток с одним метастазом в группе абемациклиба (31,9 %) по сравнению с группами рибоциклиба (19,0 %) и палбоциклиба (16,6 %), где количество метастатических очагов было больше одного. Коморбидность присутствовала у 90 % пациенток. Отличия исходных характеристик пациентов, получающих разные препараты, требуют осторожности при интерпретации результатов исследования.
Заключение. Исследование ICEDORA, включавшее пациентов, принимавших ингибиторы CDK4/6 в реальной клинической практике в Москве, является одним из крупнейших в России анализов клинико-демографических характеристик, схем лечения и клинических исходов у пациентов с HR+ HER2- мрРМЖ и мРМЖ, принимающих ингибиторы CDK4/6 в РКП. Сравнительный анализ эффективности рибоциклиба, палбоциклиба и абемациклиба в РКП не планировался и не проводился из-за различий в клинико-демографических характеристиках пациентов. Необходимы более крупные многоцентровые данные со сбалансированными когортами и длительным наблюдением.
Ключевые слова
Для цитирования:
Хатьков И.Е., Андреяшкина И.И., Троценко И.Д., Матвеева О.Н., Резников В.А. СТАТЬЯ ОТОЗВАНА: Исследование ICEDORA: клинико-демографическая характеристика и схемы лечения пациентов с HR+ HER2- местнораспространённым или метастатическим раком молочной железы, принимающих ингибиторы CDK4/6, в реальной клинической практике. Реальная клиническая практика: данные и доказательства. 2025;5(2):83-100. https://doi.org/10.37489/2782-3784-myrwd-076. EDN: EFAKGL
For citation:
Khatkov I.E., Andreyashkina I.I., Trotsenko I.D., Matveeva O.N., Reznikov V.A. RETRACTED: The ICEDORA study: clinical and demographic characteristics and treatment regimens of patients with HR+ HER2- locally advanced or metastatic breast cancer receiving CDK4/6 inhibitors in real clinical practice. Real-World Data & Evidence. 2025;5(2):83-100. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-076. EDN: EFAKGL
Введение / Introduction
Рак молочной железы (РМЖ) является самым распространённым онкологическим заболеванием среди женщин в России. В 2023 году было диагностировано 74 008 новых случаев РМЖ, что составляет 19,1 % от всех выявленных злокачественных новообразований. Согласно опубликованным данным, приблизительно у 7,4 % женщин с впервые выявленным РМЖ находят отдалённые метастазы, и примерно в 17 % случаев РМЖ диагностируется на III стадии [1].
Рандомизированные клинические исследования (РКИ) продемонстрировали значительные преимущества использования ингибиторов CDK4/6 — рибоциклиба, палбоциклиба и абемациклиба — в сочетании с эндокринной терапией (ЭТ) у пациенток с положительным по гормональным рецепторам (HR+) и отрицательным по рецептору эпидермального фактора роста человека 2-го типа (HER2-) распространённым РМЖ (рРМЖ) в первой и последующих линиях терапии по показателю выживаемость без прогрессирования (ВБП) [2–8].
Данные, полученные в РКИ, демонстрируют надёжные доказательства клинической эффективности ингибиторов CDK4/6. Исследования, ретроспективно проводимые на данных РКП, встречают множество трудностей, в том числе несоответствие клинико-демографических характеристик пациентов критериям включения в РКИ и несбалансированность групп сравнения. В итоге, исследования эффективности ингибиторов CDK4/6 в РКП могут показывать результаты как согласующиеся, так и отличающиеся от результатов РКИ [9–15].
Анализ ретроспективных данных в рамках исследования ICEDORA впервые в России позволил на большой выборке пациентов получить обширную информацию о применении комбинированной гормонотерапии в РКП, проанализировать характеристики пациентов, схемы и исходы лечения.
Цели / Objectives
ICEDORA — неинтервенционное ретроспективное исследование характеристик пациентов, подходов к лечению и клинических исходов пациентов HR+ HER2- местнораспространённым или метастатическим РМЖ (мрРМЖ или мРМЖ), принимающих рибоциклиб, палбоциклиб, абемациклиб в Москве.
Основная цель исследования заключалась в описании клинического портрета пациента, принимающего ингибиторы CDK4/6 в РКП. Ключевой дополнительной целью являлась ретроспективная оценка эффективности и безопасности ингибиторов CDK4/6 у пациентов с HR+ HER2- мрРМЖ или мРМЖ в РКП. Анализ не планировал сравнение эффективности терапевтических опций в виду несопоставимости групп пациентов.
Материалы и методы / Materials and methods
Дизайн исследования
Ретроспективное неинтервенционное исследование ICEDORA, включавшее пациентов с HR+ HER2- мрРМЖ и мРМЖ, получающих ингибиторы CDK4/6 (рибоциклиб, палбоциклиб, абемациклиб) в реальной клинической практике. В исследование были включены пациенты с HR+ HER2- мрРМЖ и мРМЖ, принимавшие ингибиторы CDK4/6 с января 2020 года до конца декабря 2022 г. Поскольку исследование имело наблюдательный и ретроспективный характер, оно не включало протокол лечения, диагностические или терапевтические вмешательства, планирование графика визитов или получение письменного информированного согласия пациентов.
В ходе исследования собирались доступные данные о ключевых демографических характеристиках, ответе на лечение, последовательности и продолжительности лечения. Были получены следующие данные: возраст на момент выявления мрРМЖ или мРМЖ, чувствительность или резистентность к эндокринной терапии, статус ECOG в начале и при завершении приёма ингибиторов CDK4/6, характеристика первичной опухоли (уровень ER/PR, Her2/neu, Ki-67), стадия заболевания по TNM на момент диагностики, локализация и количество отдалённых метастазов, наличие сопутствующих диагнозов, варианты предшествующего лечения (хирургическое, лучевая терапия, химиотерапия), варианты сопутствующей гормонотерапии, время от постановки диагноза до начала терапии ингибиторами CDK4/6, линии терапии, время на терапии ингибиторами CDK4/6, время до прогрессирования (в т. ч. на фоне ингибиторов CDK4/6), время от постановки диагноза до верификации первых метастазов, летальный исход и причины смерти.
В исследование были включены все пациентки с HR+ HER2- мрРМЖ или мРМЖ, которые в индексный период получали терапию ингибиторами CDK4/6, итоговый объём выборки в наблюдательное исследование составил 2051 пациентки.
Возраст пациенток учитывали на момент выявления РМЖ. В отношении описания уровня экспрессии рецепторов прогестерона (PR) или эстрогена (ER) на клетках опухоли использовался балльный метод со следующими оценками: 0 (отрицательный результат), 1–3 (низкий уровень, может переходить в промежуточные значения, частично положительный результат), 4–8 (высокий уровень, положительный результат).
Динамику функционального статуса оценивали по системе ECOG: 0 (пациенты полностью функциональны, могут вести активную жизнь), 1 (пациенты могут участвовать в активностях, но ограничены в физических нагрузках), 2 (пациенты способны выполнять основные действия, но требуют отдыха в течение дня), 3 (пациенты зависимы от посторонней помощи, но могут сидеть или лежать), 4 (пациенты полностью недееспособны и требуют постоянного ухода).
Статистический анализ
Анализ общей выживаемости (ОВ) производили с применением множительного метода Каплана-Мейера. С целью минимизировать влияние искажающих факторов на результат ОВ больных рассчитывалась либо с даты выявления IV стадии заболевания, либо с даты первого прогрессирования у больных, у которых заболевание было выявлено на более ранних стадиях до смерти пациента по любой причине (дата смерти устанавливалась на основе данных ЗАГС). Результаты представляли в виде среднего арифметического времени дожития в месяцах, медианы дожития в месяцах (времени, до которого дожили 50 % пациенток в соответствующей группе лечения), а также 95 % доверительного интервала (95 % ДИ) для медианы дожития.
Результаты / Results
Клинико-демографическая характеристика пациентов
Клинико-демографическая характеристика и данные по количеству участниц исследования, получавших ингибиторы CDK4/6 (рибоциклиб, палбоциклиб, абемациклиб), представлены в табл. 1. Большинство пациенток получали палбоциклиб (1204; 58,7 %) или рибоциклиб (712; 34,7 %). Абемациклиб использовался в схеме лечения всего у 135 (6,6 %) пациенток. Этот дисбаланс отражает реальную клиническую практику и не может контролироваться или корректироваться организаторами наблюдательных исследований во избежание внесения неконтролируемых искажений и систематических ошибок. Важно отметить, что с методологической и аналитической точек зрения почти десятикратная разница в размере групп палбоциклиба и абемациклиба, а также почти двухкратная между палбоциклибом и рибоциклибом, ведёт к различной достоверности оценок для этих групп, что затрудняет статистическую и клиническую интерпретацию результатов.
Медиана возраста пациенток на момент стадирования РМЖ составила 58 лет (табл. 1). Возраст в группах рибоциклиба и палбоциклиба практически не отличался: медианы — 58 и 58 лет соответственно. В группе абемациклиба средний возраст был значительно выше и составил по медиане 62 года.
Стадия заболевания была известна для подавляющего большинства пациенток (табл. 1). В структуре общей популяции преобладали пациентки со стадией 4 (42,1 %), примерно равное количество пациенток имели стадии 2 или 3 (26,1 и 23,8 % соответственно), у 160 пациенток (7,8 %) РМЖ был диагностирован на стадии I. Межгрупповые различия в структуре стадий не достигли статистической значимости (p=0,078, критерий «хи-квадрат»), при этом следует отметить тенденцию к преобладанию более распространённых стадий в группе абемациклиба. В отношении отдалённых метастазов (M), выявляемых при de novo РМЖ или в результате рецидива заболевания с более ранних стадий, различия в группах достигли статистической значимости (p=0,021, критерий «хи-квадрат») за счёт более высокой частоты de novo метастатического РМЖ в группе абемациклиба (51,9 %) по сравнению с группами рибоциклиба (43,5 %) и палбоциклиба (40,1 %), где чаще регистрировали появление отдалённых метастазов рака, выявленного на более ранних стадиях. В целом распределение стадий и выявленные тенденции отражают структуру, характерную для заболевания в целом.
У большинства пациенток (табл. 1) был зарегистрирован негативный статус по наличию человеческого рецептора эпидермального фактора роста 2 (Her2/neu) (83,5 % в общей популяции), у 308 пациенток (15,0 %) информация об экспрессии рецептора Her2/neu отсутствовала, у 31 (1,5 %) был положительным. Группы рибоциклиба, палбоциклиба и абемациклиба были однородными по статусу Her2/neu (p=0,592, точный критерий Фишера).
Данные по уровню рецепторов прогестерона (PR) и эстрогена (ER) отсутствовали более чем для половины пациенток в общей популяции (63,5 и 61,4 % соответственно). Среди остальных у 22 % пациенток был выявлен низкий уровень PR, у 10,1 % высокий, у 4,4 % получен отрицательный результат. Межгрупповые различия для уровня рецепторов прогестерона выявлены не были (p=0,340, критерий «хи-квадрат»). Для рецепторов эстрогена (ER) у 22,2 % пациенток был зафиксирован низкий уровень, у 14,9 % высокий и у 1,5 % получен отрицательный результат. Были выявлены значимые различия между группами исследуемых препаратов (p=0,005, критерий Фишера-Фримена-Хальтона), обусловленные значительно большей представленностью пациентов с высоким уровнем ER в группе абемациклиба (27,4 %) по сравнению с группами рибоциклиба и палбоциклиба (16,4 и 12,5 % соответственно). Однако из-за ограниченности информации по уровню ER и PR, экстраполяцию полученных данных на общую выборку необходимо делать с осторожностью.
Данные для оценки маркера пролиферации Ki-67 были доступны для 1471 пациентки из 2051. В общей популяции среднее значение Ki-67 составило 33,8 %, что соответствует высокому уровню пролиферации, при этом медиана составила 28 % (пороговое значение для умеренного уровня пролиферации). В группе абемациклиба показатель Ki-67 статистически значимо (p=0,029, критерий Краскела-Уоллиса) выше (среднее значение 39,2 %, медиана 35 %), чем в группе рибоциклиба (среднее значение 33,7 %, медиана 29 %) и палбоциклиба (среднее значение 33,2 %, медиана 27 %).
Среди пациенток общей популяции, у которых были зафиксированы метастазы, в подавляющем большинстве случаев они определялись в одной (18,4 %), двух (13,8 %), трёх (9,0 %) или четырёх (4,9 %) локализациях. Метастазы в 5–8 локализациях суммарно встречались менее чем у 5 % женщин. При сравнении групп исследуемых препаратов были зафиксированы статистически значимые отличия в количестве метастазов между группами (p=0,021, критерий Фишера-Фримена-Хальтона), в первую очередь за счёт значительно большей доли пациенток с одним метастазом (31,9 %) в группе абемациклиба по сравнению с группами рибоциклиба (19,0 %) и палбоциклиба (16,6 %). Наиболее частой локализацией отдалённых метастазов были кости (41,1 %), лёгкие (17,7 %), лимфоузлы (16,8 %) и печень (14,1 %) (табл. 1). Статистически значимые отличия между группами исследуемых препаратов выявлены только для метастазов в брюшине: в группе палбоциклиба частота таких метастазов была почти в 2 раза ниже (1,7 %), чем в группах рибоциклиба и абемациклиба (3,2 и 3,7 % соответственно; p=0,04, критерий Фишера-Фримена-Хальтона). Кроме того, выявлен тренд на более высокую частоту отдалённых метастазов в лимфоузлы в группе абемациклиба (23,7 %) по сравнению с группами рибоциклиба и палбоциклиба (17,3 и 15,8 % соответственно).
Большинство пациенток, включённых в исследование, имели сопутствующие заболевания (табл. 1). В общей сложности коморбидность зафиксирована почти у 90 % пациенток, без существенных отличий между группами.
Таблица 1. Клинико-демографические характеристики пациентов, включённых в исследование ICEDORA Table 1. Clinical and demographic characteristics of patients included in the ICEDORA study | ||||
Характеристики | Группы по исследуемым препаратам | Общая популяция | ||
Рибоциклиб | Палбоциклиб | Абемациклиб | ||
Количество пациентов, n (%) | 712 (34,7 %) | 1204 (58,7 %) | 135 (6,6 %) | 2051 (100 %) |
Возраст на момент постановки диагноза Средний, лет (мин-макс) Медиана, лет (Q1-Q3) | 57,0 (26–85) 58 (48–66) | 57,5 (23–92) 58 (49–66) | 60,1 (31–88) 62 (53–70) | 57,5 (23–92) 58 (49–66) |
Анатомическая стадия заболевания на момент постановки диагноза, n (%) I II III IV Нет данных | 54 (7,6 %) 173 (24,3 %) 175 (24,6 %) 309 (43,4 %) 1 (0,1 %) | 101 (8,4 %) 335 (27,8 %) 282 (23,4 %) 485 (40,3 %) 1 (0,1 %) | 5 (3,7 %) 28 (20,7 %) 32 (23,7 %) 69 (51,1 %) 1 (0,7 %) | 160 (7,8 %) 536 (26,1 %) 489 (23,8 %) 863 (42,1 %) 3 (0,2 %) |
T, n (%) T0 T1 T2 T3 T4 | 3 (0,4 %) 120 (17,0 %) 285 (40,3 %) 69 (9,8 %) 231 (32,6 %) | 4 (0,3 %) 213 (17,8 %) 501 (41,9 %) 105 (8,8 %) 372 (31,1 %) | 2 (1,5 %) 13 (9,8 %) 58 (43,6 %) 10 (7,5 %) 50 (37,6 %) | |
N, n (%) N0 N1 N2 N3 | 181 (26,2 %) 283 (41,0 %) 101 (14,6 %) 126 (18,2 %) | 311 (26,5 %) 477 (40,6 %) 176 (15,0 %) 212 (18,0 %) | 26 (19,9 %) 52 (39,7 %) 20 (15,3 %) 33 (25,2 %) | |
M, n (%) M0 M1 | 402 (56,5 %) 309 (43,5 %) | 718 (59,9 %) 481 (40,1 %) | 65 (48,2 %) 70 (51,9 %) | |
Her2/neu, n (%) негативный позитивный нет данных | 597 (83,9 %) 14 (2,0 %) 101 (14,2 %) | 991 (82,3 %) 16 (1,3 %) 197 (16,4 %) | 124 (91,9 %) 1 (0,7 %) 10 (7,4 %) | 1712 (83,5 %) 31 (1,5 %) 308 (15,0 %) |
Баллы PR, n (%)а 0 1–3 4–8 нет данных | 32 (4,5 %) 159 (22,3 %) 83 (11,7 %) 438 (61,5 %) | 48 (4,0 %) 260 (21,6 %) 104 (8,6 %) 792 (65,8 %) | 10 (7,4 %) 32 (23,7 %) 20 (14,8 %) 73 (54,1 %) | 90 (4,4 %) 451 (22,0 %) 207 (10,1 %) 1303 (63,5 %) |
Баллы ER, n (%)а 0 1–3 4–8 нет данных | 13 (1,8 %) 155 (21,8 %) 117 (16,4 %) 427 (60,0 %) | 16 (1,3 %) 276 (22,9 %) 151 (12,5 %) 761 (63,2 %) | 2 (1,5 %) 25 (18,5 %) 37 (27,4 %) 71 (52,6 %) | 31 (1,5 %) 456 (22,2 %) 305 (14,9 %) 1259 (61,4 %) |
Характеристики | Группы по исследуемым препаратам | Общая популяция | ||
Рибоциклиб | Палбоциклиб | Абемациклиб | ||
Ki-67 Количество пациентов с известным Ki-67, n Среднее значение, % (95 %ДИ) Мин-макс, % Медиана (Q1-Q3), % | 528 33,7 (31,9–35,5) 0,2–98,0 29 (20–44) | 837 33,2 (31,7–34,6) 0,4–98,0 27 (20–42) | 106 39,2 (34,6–43,9) 0,3–99,0 35 (22–55) | 1471 33,8 (32,7–34,9) 0,2–99,0 28 (20–44,5) |
Количество отдалённых метастазовб, n (%) 0 1 2 3 4 5 6 7 8 | 343 (48,2 %) 135 (19,0 %) 97 (13,6 %) 69 (9,7 %) 39 (5,5 %) 17 (2,4 %) 5 (0,7 %) 4 (0,6 %) 3 (0,4 %) | 629 (52,2 %) 200 (16,6 %) 166 (13,8 %) 104 (8,6 %) 54 (4,5 %) 34 (2,8 %) 12 (1,0 %) 4 (0,3 %) 1 (0,1 %) | 47 (34,8 %) 43 (31,9 %) 20 (14,8 %) 12 (8,9 %) 8 (5,9 %) 3 (2,2 %) 2 (1,5 %) 0 (0,0 %) 0 (0,0 %) | 1019 (49,7 %) 378 (18,4 %) 283 (13,8 %) 185 (9,0 %) 101 (4,9 %) 54 (2,6 %) 19 (0,9 %) 8 (0,4 %) 4 (0,2 %) |
Локализация отдалённых метастазов, n (%) кости печень легкие лимфоузлы кожа плевра костный мозг брюшина головной мозг надпочечники другое | 307 (43,1 %) 94 (13,2 %) 126 (17,7 %) 123 (17,3 %) 16 (2,3 %) 53 (7,4 %) 9 (1,3 %) 23 (3,2 %) 17 (2,4 %) 6 (0,8 %) 85 (11,9 %) | 475 (39,5 %) 180 (15,0 %) 205 (17,0 %) 190 (15,8 %) 24 (2,0 %) 83 (6,9 %) 10 (0,8 %) 20 (1,7 %) 27 (2,2 %) 7 (0,6 %) 117 (9,7 %) | 60 (44,4 %) 15 (11,1 %) 32 (23,7 %) 32 (23,7 %) 3 (2,2 %) 15 (11,1 %) 1 (0,7 %) 5 (3,7 %) 4 (3,0 %) 0 (0,0 %) 11 (8,2 %) | 842 (41,1 %) 289 (14,1 %) 363 (17,7 %) 345 (16,8 %) 43 (2,1 %) 151 (7,4 %) 20 (1,0 %) 48 (2,3 %) 48 (2,3 %) 13 (0,6 %) 213 (10,4 %) |
Наличие сопутствующих заболеваний, n (%) болезни артерий со стороны крови болезни системы кровообращения со стороны костно-мышечной системы со стороны соединительной ткани диабет со стороны пищеварительной системы со стороны эндокринной системы болезни глаза гипертензия иммунодефицитные состояния беременность болезни вен и лимфатических сосудов болезни кожи со стороны мочевыделительной системы со стороны органов дыхания со стороны печени со стороны почек со стороны сердца инфекционные заболевания ревматоидные заболевания другие болезни Всего | 22 (3,1 %) 106 (14,9 %) 204 (28,7 %) 175 (24,6 %) 3 (0,4 %) 74 (10,4 %) 149 (20,9 %) 124 (17,4 %) 169 (23,7 %) 377 (53,0 %) 2 (0,3 %) 4 (0,6 %) 160 (22,5 %) 80 (11,2 %) 198 (27,8 %) 147 (20,7 %) 51 (7,2 %) 36 (5,1 %) 4 (0,6 %) 38 (5,3 %) 1 (0,1 %) 97 (13,6 %) 639 (89,8 %) | 44 (3,7 %) 206 (17,1 %) 365 (30,3 %) 306 (25,4 %) 8 (0,7 %) 165 (13,7 %) 255 (21,2 %) 242 (20,1 %) 294 (24,4 %) 638 (53,0 %) 4 (0,3 %) 2 (0,2 %) 278 (23,1 %) 111 (9,2 %) 320 (26,6 %) 245 (20,4 %) 52 (4,3 %) 57 (4,7 %) 5 (0,4 %) 61 (5,1 %) 3 (0,3 %) 170 (14,1 %) 1088 (90,4 %) | 7 (5,2 %) 21 (15,6 %) 33 (24,4 %) 36 (26,7 %) 0 (0,0 %) 10 (7,4 %) 16 (11,9 %) 23 (17,0 %) 24 (17,8 %) 68 (50,4 %) 0 (0,0 %) 0 (0,0 %) 23 (17,0 %) 24 (17,8 %) 39 (28,9 %) 19 (14,1 %) 6 (4,4 %) 8 (5,9 %) 4 (3,0 %) 5 (3,7 %) 0 (0,0 %) 14 (10,4 %) 115 (85,2 %) | 73 (3,6 %) 333 (16,2 %) 602 (29,4 %) 517 (25,2 %) 11 (0,5 %) 249 (12,1 %) 420 (20,5 %) 389 (19,0 %) 487 (23,7 %) 1083 (52,8 %) 6 (0,3 %) 6 (0,3 %) 461 (22,5 %) 215 (10,5 %) 557 (27,2 %) 411 (20,0 %) 109 (5,3 %) 101 (4,9 %) 13 (0,6 %) 104 (5,1 %) 4 (0,2 %) 281 (13,7 %) 1842 (89,8 %) |
Неоадъювантнаяв лучевая терапия, n (%) Да Нет | 254 (35,7 %) 458 (64,3 %) | 422 (35,1 %) 782 (65,0 %) | 37 (27,4 %) 98 (72,6 %) | 713 (34,8 %) 1338 (65,2 %) |
Хирургическое лечениев, n (%) Да Нет | 376 (52,8 %) 336 (47,2 %) | 670 (55,6 %) 534 (44,4 %) | 59 (43,7 %) 76 (56,3 %) | 1105 (53,9 %) 946 (46,1 %) |
Характеристики | Группы по исследуемым препаратам | Общая популяция | ||
Рибоциклиб | Палбоциклиб | Абемациклиб | ||
Предшествующаяв химиотерапия, n (%) Да Нет | 405 (56,9 %) 307 (43,1 %) | 677 (56,2 %) 527 (44,8 %) | 70 (51,9 %) 65 (48,1 %) | 1152 (56,2 %) 899 (44,8 %) |
Примечания: a 0 баллов — нет экспрессии (отрицательный результат), 1–3 балла — низкая степень экспрессии, может переходить в промежуточные значения (частично положительный), 4–8 баллов — высокая степень экспрессии (положительный результат); б на момент постановки диагноза; в лечение, которое применялось до начала применения исследуемых лекарственных препаратов (ингибиторов CCDK4/6). Notes: a — 0 points — no expression (negative result), 1–3 points — low degree of expression, may go into intermediate values (partially positive), 4–8 points — high degree of expression (positive result); b — at the time of diagnosis; c treatment that was used before the start of the study drugs (CCDK4/6 inhibitors). | ||||
Динамика статуса ECOG
Анализ данных ECOG был проведён только для пациенток, у которых функциональный статус был известен как до начала приёма ингибиторов CDK4/6, так и в процессе или по окончании приёма исследуемых препаратов. В итоге в выборки для анализа динамики статуса ECOG вошли 129 пациенток из группы рибоциклиба, 190 пациенток из группы палбоциклиба и 30 пациенток из группы абемациклиба. На фоне применения ингибиторов CDK4/6 произошло некоторое ухудшение функционального статуса (p <0,05, точный критерий Фишера), в основном за счёт перехода пациенток с ECOG 0 в категорию ECOG 1 (рис. 1), что непосредственно связано с прогрессированием заболевания. Существенного увеличения доли пациенток со значительными ограничениями функционального статуса ни в одной из групп не произошло. Различий по функциональному статусу ECOG между группами рибоциклиба, палбоциклиба и абемациклиба не было выявлено ни до начала приёма препаратов (p=0,585, точный критерий Фишера), ни в процессе или по завершению лечения (p=0,114, точный критерий Фишера).
В табл. 2 представлено распределение пациенток по направлению изменений статуса ECOG (без изменений, ухудшение, улучшение), а также по наличию или отсутствию изменений статуса в целом, без учёта его направления. Статистически значимых различий не было выявлено ни в отношении направления изменений (p=0,796, точный критерий Фишера), ни по их наличию или отсутствию (p=0,725, критерий «хи-квадрат»). Усреднённо по всем группам у 45 % пациенток изменений статуса ECOG зафиксировано не было, ещё у 45 % функциональный статус ухудшился, и у остальных 10 % произошло улучшение состояния. Медиана изменения (табл. 2) во всех группах составила +1 балл, что соответствует изменению в сторону увеличения функциональных ограничений и согласуется с данными о том, что динамика во всех группах преимущественно связана с переходом пациенток из категории ECOG 0 в категорию ECOG 1.
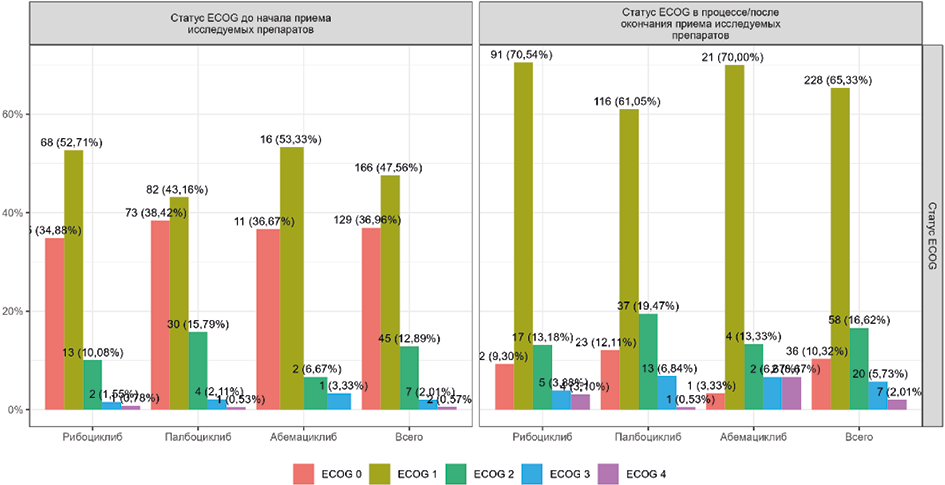
Рис. 1. Динамика статуса ECOG в исследовании ICEDORA
Fig. 1. Dynamics of ECOG status in the ICEDORA study
Таблица 2. Изменение статуса ECOG в исследовании ICEDORA Table 2. Change in ECOG performance status in the ICEDORA study | |||
Изменение статуса ECOG | Рибоциклиб (N = 129) | Палбоциклиб (N = 190) | Абемациклиб (N = 30) |
Без изменений | 62 (48,1 %) | 83 (43,7 %) | 13 (43,3 %) |
Статус изменился | 67 (51,9 %) | 107 (56,3 %) | 17 (56,7 %) |
Увеличение (ухудшение состояния) | 52 (40,3 %) | 81 (42,6 %) | 15 (50,0 %) |
Снижение (улучшение состояния) | 15 (11,6 %) | 26 (13,7 %) | 2 (6,7 %) |
Медиана изменения статусаа, балл (мин — макс) | 1 (–3 — +3) | 1 (–3 — +3) | 1 (–2 — +4) |
Примечания: а — разница баллов у пациентов с изменением (отрицательные значения говорят о снижении балла ECOG, т. е. улучшении функционального статуса). Notes: a — the difference in scores in patients with a change (negative values indicate a decrease in the ECOG score, i. e. an improvement in functional status). | |||
Лечение, предшествовавшее назначению ингибиторов CDK4/6
Адъювантная лучевая терапия назначалась с приблизительно одинаковой частотой во всех группах (табл. 1). Хотя частота применения лучевой терапии в группе абемациклиба была численно ниже, но статистически значимых различий с другими группами выявлено не было (p=0,172, критерий «хи-квадрат»). В отношении хирургического лечения, проведённого до начала применения исследуемых препаратов, напротив, между группами имеются статистически значимые отличия (p=0,024, критерий «хи-квадрат») за счёт более низкой частоты хирургического лечения в анамнезе в группе абемациклиба (43,7 %). Данный факт связан с более высокой частотой de novo метастатического РМЖ в группе абемациклиба, что исключало возможность проведения хирургического лечения. Частота хирургического лечения в анамнезе в группах рибоциклиба и палбоциклиба была сопоставимой: 52,8 и 55,7 % соответственно.
Наиболее частыми компонентами схемы химио- терапии были циклофосфамид (21,3 %), доксорубицин (18,2 %) и паклитаксел (15,7 %) (табл. 3), что отражает подходы к химиотерапии РМЖ в действующих рекомендациях [16–20]. Значимых различий по каким-либо группам или позициям препаратов выявлено не было. Можно отметить, что доля пациенток, получивших химиотерапию или терапию осложнений, в группе абемациклиба была несколько ниже (51,9 %) по сравнению с группами рибоциклиба (56,9 %) и палбоциклиба (56,2 %), что может быть обусловлено более ранним началом терапии ингибиторами CDK4/6.
Таблица 3. Препараты для лечения РМЖ, принимаемые до начала приёма ингибиторов CDK4/6, в исследовании ICEDORA Table 3. Breast cancer medications taken before starting CDK4/6 inhibitors in the ICEDORA study | |||||
Анатомо-терапевтическо-химическая классификация | Группы по исследуемым препаратам | Общая популяция (N = 2051) | |||
класс 3 | класс 5 | Рибоциклиб (N = 712) | Палбоциклиб (N = 1204) | Абемациклиб (N = 135) | |
Алкалоиды растительного происхождения и другие природные вещества | Винорелбин | 11 (1,5 %) | 22 (1,8 %) | 2 (1,5 %) | 35 (1,7 %) |
Доцетаксел | 82 (11,5 %) | 101 (8,4 %) | 13 (9,6 %) | 196 (9,6 %) | |
Паклитаксел | 114 (16,0 %) | 187 (15,5 %) | 21 (15,6 %) | 322 (15,7 %) | |
Этопозид | 2 (0,3 %) | 4 (0,3 %) | 1 (0,7 %) | 7 (0,3 %) | |
Алкилирующие средства | Дакарбазин | 1 (0,1 %) | 0 (0,0 %) | 0 (0,0 %) | 1 (0,1 %) |
Ифосфамид | 0 (0,0 %) | 1 (0,1 %) | 0 (0,0 %) | 1 (0,1 %) | |
Циклофосфамид | 158 (22,2 %) | 241 (20,0 %) | 38 (28,2 %) | 437 (21,3 %) | |
Антагонисты гормонов и родственные соединения | Тамоксифен | 84 (11,8 %) | 112 (9,3 %) | 18 (13,33 %) | 214 (10,4 %) |
Анатомо-терапевтическо-химическая классификация | Группы по исследуемым препаратам | Общая популяция (N = 2051) | |||
класс 3 | класс 5 | Рибоциклиб (N = 712) | Палбоциклиб (N = 1204) | Абемациклиб (N = 135) | |
Антиметаболиты | Гемцитабин | 2 (0,3 %) | 8 (0,7 %) | 2 (1,5 %) | 12 (0,6 %) |
Капецитабин | 16 (2,3 %) | 42 (3,5 %) | 5 (3,7 %) | 63 (3,1 %) | |
Метотрексат | 4 (0,6 %) | 7 (0,6 %) | 1 (0,7 %) | 12 (0,6 %) | |
Фторурацил | 24 (3,4 %) | 29 (2,4 %) | 5 (3,7 %) | 58 (2,8 %) | |
Гормональные контрацептивы системного действия | Медроксипрогестерон | 2 (0,3 %) | 3 (0,3 %) | 1 (0,7 %) | 6 (0,3 %) |
Гормоны и родственные соединения | Бусерелин | 5 (0,7 %) | 5 (0,4 %) | 1 (0,7 %) | 11 (0,5 %) |
Гозерелин | 68 (9,6 %) | 84 (7,0 %) | 14 (10,4 %) | 166 (8,1 %) | |
Трипторелин | 4 (0,6 %) | 3 (0,3 %) | 4 (3,0 %) | 11 (0,5 %) | |
Другие противоопухолевые препараты | Бортезомиб | 1 (0,1 %) | 0 (0,0 %) | 0 (0,0 %) | 1 (0,1 %) |
Гидроксикарбамид | 0 (0,0 %) | 1 (0,1 %) | 0 (0,0 %) | 1 (0,1 %) | |
Карбоплатин | 37 (5,2 %) | 63 (5,2 %) | 6 (4,4 %) | 106 (5,2 %) | |
Оксалиплатин | 2 (0,3 %) | 4 (0,3 %) | 1 (0,7 %) | 7 (0,3 %) | |
Цисплатин | 4 (0,6 %) | 4 (0,3 %) | 1 (0,7 %) | 9 (0,4 %) | |
Эрибулин | 6 (0,8 %) | 16 (1,3 %) | 6 (4,4 %) | 28 (1,4 %) | |
Иммуностимуляторы | Интерферон альфа | 0 (0,0 %) | 1 (0,1 %) | 0 (0,0 %) | 1 (0,1 %) |
Ингибиторы протеинкиназы | Гефитиниб | 0 (0,0 %) | 1 (0,1 %) | 0 (0,0 %) | 1 (0,1 %) |
Лапатиниб | 2 (0,3 %) | 3 (0,3 %) | 0 (0,0 %) | 5 (0,2 %) | |
Регорафениб | 0 (0,0 %) | 1 (0,1 %) | 0 (0,0 %) | 1 (0,1 %) | |
Эверолимус | 6 (0,8 %) | 15 (1,3 %) | 1 (0,7 %) | 22 (1,1 %) | |
Моноклональные антитела и конъюгаты антител | Бевацизумаб | 20 (2,8 %) | 43 (3,6 %) | 5 (3,7 %) | 68 (3,3 %) |
Пертузумаб | 4 (0,6 %) | 4 (0,3 %) | 1 (0,7 %) | 9 (0,4 %) | |
Трастузумаб | 7 (1,0 %) | 17 (1,4 %) | 1 (0,7 %) | 25 (1,2 %) | |
Препараты для лечения язвенной болезни желудка и двенадцатиперстной кишки и ГЭРБ | Омепразол | 192 (27,0 %) | 364 (30,2 %) | 33 (24,4 %) | 589 (28,7 %) |
Противоопухолевые антибиотики и родственные соединения | Доксорубицин | 138 (19,4 %) | 213 (17,7 %) | 35 (26,0 %) | 386 (18,8 %) |
Митоксантрон | 1 (0,1 %) | 2 (0,2 %) | 0 (0,0 %) | 3 (0,2 %) | |
Митомицин | 0 (0,0 %) | 2 (0,2 %) | 0 (0,0 %) | 2 (0,1 %) | |
Эпирубицин | 29 (4,1 %) | 42 (3,5 %) | 5 (3,7 %) | 76 (3,7 %) | |
Всего | 405 (56,9 %) NOE = 1028 | 677 (56,2 %) NOE = 1649 | 70 (51,9 %) NOE = 221 | 1152 (56,2 %) NOE = 2898 | |
Примечания: N — общее количество пациентов в группе; NOE — количество эпизодов назначений препаратов; n — количество пациентов с как минимум одним эпизодом; % — (n/N) x 100. Notes: N is the total number of patients in the group; NOE is the number of drug prescription episodes; n is the number of patients with at least one episode; % is (n/N) x 100. | |||||
Гормонотерапия, сопутствующая лечению ингибиторами CDK4/6
В табл. 4 представлены данные по частоте назначения ингибиторов ароматазы, антиэстрогенов и агонистов гонадолиберинов в составе комбинированной терапии с ингибиторами CDK4/6. Поскольку каждый препарат мог назначаться пациентке в виде нескольких курсов, в таблице представлено как количество пациенток, получавших соответствующее назначение хотя бы один раз (n), так и общее количество эпизодов назначения соответствующего препарата в группе (NOE). Вследствие подобной структуры данных, прямое сравнение между группами статистическими методами затруднено, результаты представлены описательно. Из числа антагонистов женских половых гормонов чаще всего назначали анастрозол (55,0 % в общей популяции) и фулвестрант (54,4 %), несколько реже летрозол (40,5 %). Из агонистов гонадолиберинов пациентки чаще всего получали лечение гозерелином (12,8 %), и значительно реже — трипторелином (4,5 %). В группе абемациклиба по сравнению с группами рибоциклиба и палбоциклиба значительно чаще назначался анастрозол (66,7 %) и значительно реже — фулвестрант (31,1 %). В целом, гормонотерапию, сопутствующую лечению ингибиторами CDK4/6, получали 98,4 % всех пациенток, что отражает требования инструкций по применению препаратов группы ингибиторов CDK4/6.
Таблица 4. Препараты гормонотерапии, сопутствующие лечению ингибиторами CDK4/6, в исследовании ICEDORA Table 4. Hormonal therapy drugs concomitant with CDK4/6 inhibitors in the ICEDORA study | |||||
Анатомо-терапевтическо-химическая классификация | Группы по исследуемым препаратам | Общая популяция (N = 2051) | |||
класс 3 | класс 5 | Рибоциклиб (N = 712) | Палбоциклиб (N = 1204) | Абемациклиб (N = 135) | |
Антагонисты гормонов и родственные соединения | Анастрозол | 403 (56,6 %) | 634 (52,7 %) | 90 (66,7 %) | 1127 (55,0 %) |
Летрозол | 301 (42,3 %) | 475 (39,5 %) | 54 (40,0 %) | 830 (40,5 %) | |
Фулвестрант | 349 (49,0 %) | 725 (60,2 %) | 42 (31,1 %) | 1116 (54,4 %) | |
Гормоны и родственные соединения | Гозерелин | 105 (14,8 %) | 140 (11,6 %) | 18 (13,3 %) | 263 (12,8 %) |
Трипторелин | 38 (5,3 %) | 45 (3,7 %) | 9 (6,7 %) | 92 (4,5 %) | |
Всего | 705 (99,0 %) NOE = 1196 | 1181 (98,1 %) NOE = 2019 | 133 (98,5 %) NOE = 213 | 2019 (98,4 %) NOE = 3428 | |
Примечания: N — общее количество пациентов в группе; NOE — количество эпизодов назначений препаратов; n — количество пациентов с как минимум одним эпизодом; % — (n/N) x 100. Notes: N is the total number of patients in the group; NOE is the number of drug prescription episodes; n is the number of patients with at least one episode; % is (n/N) x 100. | |||||
Терапия ингибиторами CDK4/6
Время от момента выявления РМЖ до начала терапии ингибиторами CDK4/6 в общей популяции составило в среднем 4,5 года (медиана — 2,2 года) (табл. 5). Дисперсионный анализ Краскела-Уоллиса выявил статистически значимые различия между группами, получавшими различные ингибиторы CDK4/6 (p <0,001). В группе абемациклиба среднее время составило 3,0 года (медиана — 0,5 лет), что значительно меньше, чем в группах рибоциклиба (среднее — 4,3 года, медиана 2,1 года) и палбоциклиба (среднее 4,7 года, медиана — 2,8 года). Существенно меньшие медианные значения говорят о преобладании в структуре общей популяции пациенток, получавших лечение ингибиторами CDK4/6 в течение первых трёх лет от момента диагностики РМЖ. Более чем в половине случаев (56,2 %) в общей выборке ингибиторы CDK4/6 применялись в первой линии терапии (табл. 5).
На рис. 2 представлена длительность терапии ингибиторами CDK4/6. Медианы длительности приёма рибоциклиба и палбоциклиба сопоставимы и составляют 17,6 и 15,9 мес. соответственно, тогда как для абемациклиба — 7,7 мес. (табл. 5). Анализ длительности терапии ингибиторами CDK4/6 подтверждает, что значимые (p <0,0001, критерий «хи-квадрат») различия во времени обусловлены группой абемациклиба, где кривая схода с терапии и соответствующая граница доверительного интервала (пунктирные линии) полностью отделены от кривых для рибоциклиба и палбоциклиба.
Прогрессирование и смертность
Факт прогрессирования РМЖ был зафиксирован у 28,7 % пациенток общей популяции со значимыми различиями между группами исследуемых препаратов (p <0,001, критерий «хи-квадрат»). В группе абемациклиба прогрессирование было зафиксировано у 60,7 % пациенток, в группах рибоциклиба и палбоциклиба — у 29,4 и 24,7 % пациенток соответственно (табл. 6). Необходимо отметить, что данный показатель не даёт понимания о терапевтическом контексте, поэтому был проведён анализ с учётом времени до наступления события. Время от постановки диагноза до выявления метастазов составило в среднем 8,3 года (медиана — 1,7 года) без статистически значимых различий между группами (p=0,343, критерий Краскела-Уоллиса).
На фоне приёма ингибиторов CDK4/6 прогрессирование произошло у 13,3 % пациенток в общей популяции без значимых отличий между группами препаратов (p=0,146, критерий «хи-квадрат»).
Таблица 5. Основные паттерны терапии ингибиторами CDK4/6 и её длительность в исследовании ICEDORA Table 5. Main patterns of CDK4/6 inhibitor therapy and its duration in the ICEDORA study | |||||
Показатели | Рибоциклиб | Палбоциклиб | Абемациклиб | Общая популяция | Значение р (критерий) * |
Время от диагностики мРМЖ до начала терапии иCDK4/6 | |||||
Количество наблюдений, n | 711 | 1199 | 135 | 2045 | <0,001 (kw) |
Среднее, мес. | 4,3 | 4,7 | 3,0 | 4,5 | |
Медиана, мес. | 2,1 | 2,8 | 0,5 | 2,2 | |
95 % ДИ, мес. | 3,9–4,7 | 4,4–5,1 | 2,1–3,9 | 4,2–4,7 | |
Линия терапии | |||||
Количество наблюдений, n | 712 | 1204 | 135 | 2051 | 0,557 (chisq) |
1-я, n (%) | 405 (56,9 %) | 677 (56,2 %) | 70 (51,9 %) | 1152 (56,2 %) | |
2 и последующие, n (%) | 307 (43,1 %) | 527 (43,8 %) | 65 (48,2 %) | 899 (43,8 %) | |
Время на терапии ингибиторами CDK4/6 | |||||
Количество наблюдений, n | 634 | 1054 | 119 | 1807 | <0,0001 |
Среднее, мес. | 19,2 | 18,9 | 10,4 | 15,6 | |
Медиана, мес. | 17,6 | 15,9 | 7,7 | 12,9 | |
95 % ДИ, мес. | 16,0–19,5 | 14,7–17,1 | 5,8–12,1 | ||
Примечания: *kw — Краскела-Уоллиса, chisq — «хи-квадрат» Notes: *kw — Kruskal-Wallis, chisq — “chi-square” | |||||
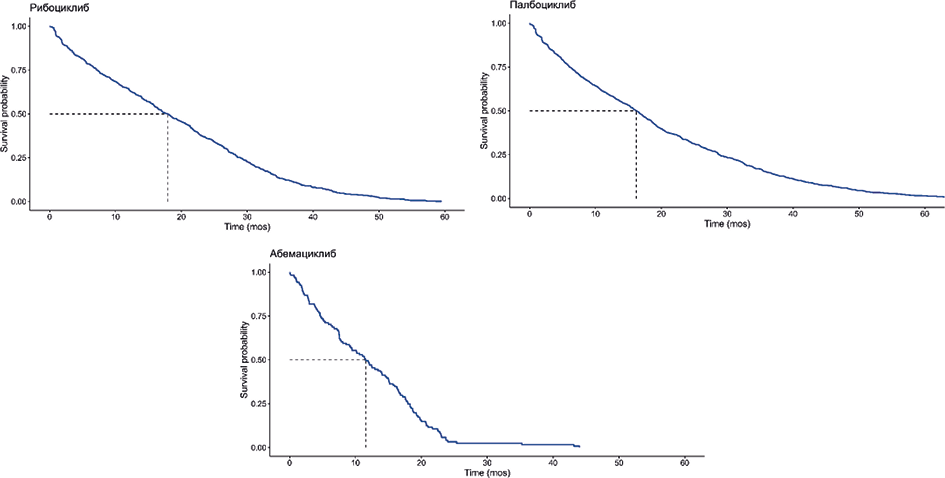
Рис. 2. Кривые схода с терапии ингибиторами CDK4/6 в исследовании ICEDORA (метод Каплана-Мейера)
Fig. 2. CDK4/6 inhibitor therapy discontinuation curves in the ICEDORA study (Kaplan-Meier method)
Таблица 6. Прогрессирование и смертность в исследовании ICEDORA Table 6. Progression and mortality in the ICEDORA study | ||||||
Показатель | Рибоциклиб (N = 712) | Палбоциклиб (N = 1204) | Абемациклиб (N = 135) | Всего (N = 2051) | Значение р (критерий) * | |
Прогрессирование, n (%) | Нет | 503 (70,7 %) | 907 (75,3 %) | 53 (39,3 %) | 1463 (71,3 %) | <0,001 (chisq) |
Да | 209 (29,4 %) | 297 (24,7 %) | 82 (60,7 %) | 588 (28,7 %) | ||
Время от постановки диагноза до верификации первых метастазов | n | 432 | 697 | 74 | 1203 | 0,343 (kw) |
Среднее, лет | 7,6 | 8,8 | 7,0 | 8,3 | ||
Медиана, лет | 1,7 | 1,9 | 0,8 | 1,7 | ||
95 % ДИ | 6,1–9,1 | 7,7–10,0 | 3,3–10,7 | 7,4–9,1 | ||
Прогрессирование на фоне ингибиторов CDK4/6, n (%) | n | 432 | 697 | 74 | 1203 | 0,146 (chisq) |
Да | 54 (12,5 %) | 101 (14,5 %) | 5 (6,8 %) | 160 (13,3 %) | ||
Нет | 378 (87,5 %) | 596 (85,5 %) | 69 (93,2 %) | 1043 (86,7 %) | ||
Летальный исход, n (%) | Да | 266 (37,4 %) | 526 (43,7 %) | 31 (23,0 %) | 823 (40,1 %) | <0,001 (chisq) |
Нет | 446 (62,6 %) | 678 (56,3 %) | 104 (77,0 %) | 1228 (59,9 %) | ||
Причина смерти | РМЖ (C50) | 225 (31,6 %) | 429 (35,6 %) | 27 (20,0 %) | 681 (33,2 %) | 0,712 (f) |
Другие | 34 (4,8 %) | 78 (6,5 %) | 4 (3,0 %) | 116 (5,7 %) | ||
Нет данных | 7 (1,0 %) | 19 (1,6 %) | 0 (0 %) | 28 (1,4 %) | ||
Примечания: *Критерии: kw — Краскела-Уоллиса, chisq — «хи-квадрат», f — точный критерий Фишера. Notes: *Criteria: kw — Kruskal-Wallis, chisq — chi-square, f — Fisher's exact test. | ||||||
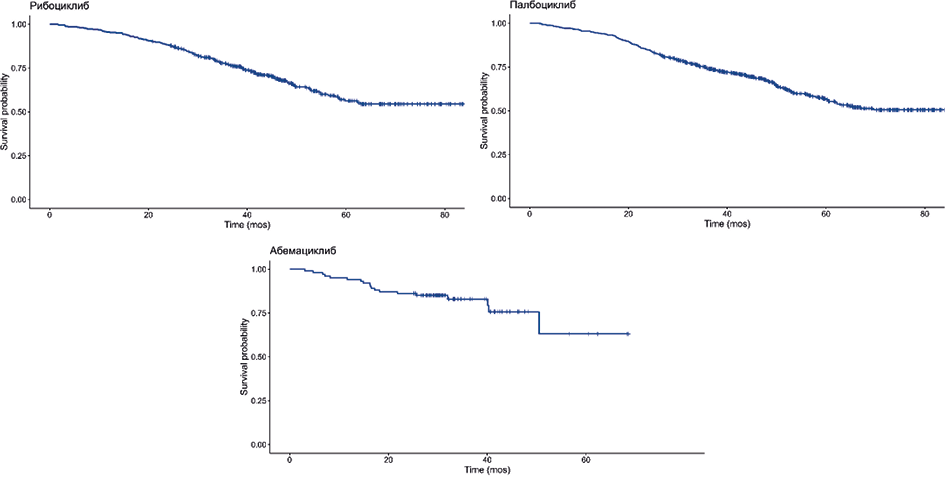
Рис. 3. Общая выживаемость в группах рибоциклиба, палбоциклиба и абемациклиба в исследовании ICEDORA (метод Каплана-Мейера)
Fig. 3. Overall survival in the ribociclib, palbociclib, and abemaciclib groups in the ICEDORA study (Kaplan- Meier method)
Примечание: Общая выживаемость рассчитывалась от постановки диагноза РМЖ до смерти пациента
Note: Overall survival was calculated from the diagnosis of breast cancer to the patient's death.
В общей сложности, из 2051 пациентки, на момент анализа умерло 823 (40,1 %). В группах лечения ингибиторами CDK4/6 выявлены статистически значимые различия в летальности (p <0,001, критерий «хи-квадрат»). Самая низкая частота летальных исходов зафиксирована в группе абемациклиба (23,0 %), на втором месте группа рибоциклиба (37,4 %) и самая высокая частота летальных исходов зафиксирована в группе палбоциклиба (43,7 %). РМЖ как причина смерти, был указан для 33,2 % умерших пациенток в общей популяции и для 31,6 % пациенток, умерших в группе рибоциклиба, 35,6 % в группе палбоциклиба и 20 % в группе абемациклиба (табл. 6). Учитывая выявленные ранее различия в возрасте, частоте метастазов и уровне рецепторов при гистологическом типировании опухоли, эти различия могут быть связаны с особенностями соответствующих групп. Для подтверждения этого результата требуется дополнительное исследование с использованием многофакторного анализа, особенно учитывая разнонаправленный характер полученных данных.
Общая выживаемость
Медиана ОВ рассчитывалась от момента постановки диагноза РМЖ до смерти пациента. Показатель во всех группах оказался сходным и составил 11,9 лет для рибоциклиба, 10,1 года для палбоциклиба и 12,6 года для абемациклиба (рис. 3). На графиках видно отсутствие статистически значимых различий и подтверждается результатами лог-рангового теста (p=0,75). Важно отметить, что показатель не может отражать терапевтический эффект исследуемых лекарственных препаратов в группах, поскольку группы не были сбалансированы и не исключается влияние вмешивающихся факторов.
Данные по выживаемости в группе абемациклиба следует интерпретировать с осторожностью, так как высока вероятность случайных ошибок малой выборки.
Обсуждение / Discussion
Появление ингибиторов CDK4/6 кардинально изменило подход к лечению распространённого и метастатического HR+ HER2- РМЖ, став основой первой линии терапии [16–20]. Хотя РКИ [2–8][21–27] убедительно доказали их эффективность, прямые сопоставления этих препаратов в РКП всё ещё ограничены. Поэтому выбор конкретного ингибитора CDK4/6 в повседневной медицинской практике зачастую определяется такими факторами, как доступность препаратов, профиль побочных эффектов, сопутствующие болезни пациента и его индивидуальная восприимчивость. Таким образом, клинико-демографическая характеристика пациента играет одну из ключевых ролей при выборе ингибитора CDK4/6.
В исследовании ICEDORA в структуре общей популяции преобладали пациентки на IV стадии заболевания (около 42,1 %), тогда как пациенток с рецидивом I стадии суммарно встречалось лишь 7,8 %. Внутри каждой группы распределение стадий было схожим, со значительным преобладанием более поздних, что подчёркивает важность анализа эффективности ингибиторов CDK4/6 у пациентов с мрРМЖ и мРМЖ в реальной клинической практики в России. У большинства пациенток присутствовали сопутствующие заболевания, такие как диабет, гипертензия, болезни системы кровообращения и другие. Это указывает на наличие значительного количества коморбидных состояний среди участников исследования. Пациенты проходили различные виды лечения перед приёмом ингибиторов CDK4/6, включая химиотерапию и хирургические операции. Лучевая терапия использовалась относительно равномерно во всех группах.
Наибольшее сходство выявлено между группами пациентов, принимавших рибоциклиб и палбоциклиб, в то время как пациенты, принимавшие абемациклиб, значительно отличались по своим клинико-демографическим характеристикам (табл. 1). Так, пациенты в группе абемациклиба были статистически значимо старше пациентов из двух других групп, среди них наблюдалось большее количество пациентов с более поздними стадиями заболевания и чаще диагностировался de novo метастатический РМЖ. В связи с этим и частота хирургического лечения в анамнезе в этой группе была значительно ниже, чем в группах рибоциклиба и палбоциклиба. Кроме того группа абемациклиба характеризовалась самым высоким уровнем ER и Ki-67, включала наибольшее количество пациенток с отдалёнными метастазами и демонстрировала самое короткое время от момента диагностики до начала терапии ингибиторами CDK4/6. Доля пациенток, получавших химиотерапию, была ниже, чем в группах рибоциклиба и палбоциклиба, что может быть связано с более ранним началом терапии ингибиторами CDK4/6. Продолжительность терапии ингибиторами CDK4/6 в группе абемациклиба была значительно меньше, чем в группах рибоциклиба и палбоциклиба (табл. 5). Всё это может указывать на более агрессивное течение заболевания у пациенток данной группы, а также свидетельствовать о различиях в ответе на лечение и необходимости более раннего переключения на альтернативные методы терапии. Кроме того, в группе абемациклиба чаще назначались ингибиторы ароматазы (анастрозол) и реже — агонисты гонадолиберинов (фулвестрант) (табл. 4). Это отличие может быть связано с особенностями клинической практики или индивидуальными характеристиками пациенток. Таким образом, представленные выше особенности формируют портрет пациентов группы абемациклиба, отличающийся от двух других групп.
Ещё одним значимым различием между группами лечения, которое осложняет статистический анализ и клиническое сравнение полученных результатов, является количество пациентов в группах лечения. Размер группы палбоциклиба (N = 1204) почти в два раза превышал размер группы рибоциклиба (N = 712) и почти в десять раз — размер группы абемациклиба (N = 135). Разница в размере выборок связана с различными датами регистрации ингибиторов CDK4/6 для применения в Российской Федерации. Палбоциклиб был одобрен в октябре 2016 г., рибоциклиб — в январе 2018 г., а абемациклиб — в августе 2019 г. [28].
Все эти факторы могут быть причиной, по которой в исследовании ICEDORA не было выявлено различий в эффективности ингибиторов CDK4/6. Медианы ОВ оказались сходными в трёх группах лечения. Обращает на себя внимание тот факт, что эти значения практически в два раза превышают показатели, полученные в РКИ: 63,9 мес. (MONALEESA-2), 58,7 мес. (MONALEESA-7) и 52,2 мес. (MONALEESA-3) для рибоциклиба [7][23][24]; 53,9 мес. (PALOMA-2) и 34,8 мес. (PALOMA-3) для палбоциклиба [22][27]; 46,7 мес. (MONARCH-2) и 66,8 мес. (MONARCH-3) для абемациклиба [21][26]. Причиной такой длительности являются методологические особенности исследования ICEDORA, где ОВ определялась как время от даты постановки диагноза до даты смерти по любой причине, в то время как в РКИ — от даты рандомизации до даты смерти по любой причине. Таким образом, на результаты ОВ, полученные в данном исследовании, влиял комплекс факторов, включающий не только характеристики пациентов, но и методологические особенности исследования. Такие несоответствия подчёркивают трудности перевода результатов РКИ в реальные условия, где пациенты часто имеют более сложные исходные характеристики, более широкий спектр сопутствующих заболеваний и менее строгие протоколы последующего наблюдения по сравнению с участниками РКИ.
Сильными сторонами данного анализа является разнообразие представленных групп пациентов и полнота данных о пациентах, принимавших ингибиторы CDK4/6 в реальной клинической практике в Москве.
Данное исследование имеет несколько ограничений. Это был ретроспективный анализ базы данных с потенциальным риском предвзятости выбора лечения и неточной или неполной регистрации данных. Никакие причинно-следственные связи установлены не были. Размеры выборок в группах абемациклиба (n=135), рибоциклиба (n=712) и палбоциклиба (n=1204) значительно различались, что исключало возможность проведения формального анализа непревосходства. Определение ОВ, использованное в данном исследовании, отличалось от определения ОВ, используемого в РКИ, что привело к невозможности сравнения полученных данных с результатами РКИ. Статистически незначимые различия в ОВ между тремя ингибиторами CDK4/6 в данном анализе не демонстрируют эквивалентность; для таких выводов потребовался бы формальный анализ непревосходства или эквивалентности. Кроме того, некоторые подгруппы могут быть ограничены недостаточным размером выборки. Наконец, результаты данного исследования могут оказаться неприменимыми к группам пациентов, клинико-демографические характеристики которых отличаются от представленных в данном исследовании.
Заключение / Conclusion
Исследование ICEDORA представляет собой крупнейший в России анализ клинико-демографических характеристик, схем лечения и клинических исходов у пациентов с HR+ HER2- мрРМЖ и мРМЖ, принимающих ингибиторы CDK4/6 в реальной клинической практике (РКП) в городе Москве. Оно показало, что сравнение эффективности рибоциклиба, палбоциклиба и абемациклиба в РКП сопряжено со значительными трудностями, обусловленными различиями в характеристиках пациентов, которым назначают тот или иной препарат.
К результатам данного исследования, касающимся эффективности лечения, стоит подходить с максимальной осторожностью из-за существенных различий в размерах выборок и клинико-демографических характеристик групп пациентов, принимавших палбоциклиб, рибоциклиб и абемациклиб.
Данный анализ подчёркивает, что в случае необходимости сравнения трёх ингибиторов CDK4/6 целесообразно проводить хорошо спланированные проспективные исследования, которые будут в состоянии обеспечить однородность групп пациентов и достаточную статистическую мощность выборки. Тем не менее, учитывая, что в настоящее время не проводятся контролируемые клинические исследования с целью прямого сравнения трёх ингибиторов CDK4/6, результаты данного анализа могут быть полезны при выборе подходящего препарата для пациентов с HR+ HER2- мрРМЖ и мРМЖ в условиях РКП в России.
Список литературы
1. Состояние онкологической помощи населению России в 2023 году. Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2024. − ил. – 262 с.
2. Cristofanilli M, Turner NC, Bondarenko I, Ro J, Im SA, Masuda N, Colleoni M, DeMichele A, Loi S, Verma S, Iwata H, Harbeck N, Zhang K, Theall KP, Jiang Y, Bartlett CH, Koehler M, Slamon D. Fulvestrant plus palbociclib versus fulvestrant plus placebo for treatment of hormone-receptor-positive, HER2-negative metastatic breast cancer that progressed on previous endocrine therapy (PALOMA-3): final analysis of the multicentre, double-blind, phase 3 randomised controlled trial. Lancet Oncol. 2016;17(4):425-439. doi: 10.1016/S1470-2045(15)00613-0
3. Sledge GW Jr, Toi M, Neven P, Sohn J, Inoue K, Pivot X, Burdaeva O, Okera M, Masuda N, Kaufman PA, Koh H, Grischke EM, Frenzel M, Lin Y, Barriga S, Smith IC, Bourayou N, Llombart-Cussac A. MONARCH 2: Abemaciclib in Combination With Fulvestrant in Women With HR+/HER2- Advanced Breast Cancer Who Had Progressed While Receiving Endocrine Therapy. J Clin Oncol. 2017;35(25):2875-2884. doi: 10.1200/JCO.2017.73.7585
4. Hortobagyi GN, Stemmer SM, Burris HA, Yap YS, Sonke GS, Paluch-Shimon S, Campone M, Petrakova K, Blackwell KL, Winer EP, Janni W, Verma S, Conte P, Arteaga CL, Cameron DA, Mondal S, Su F, Miller M, Elmeliegy M, Germa C, O'Shaughnessy J. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positive, HER2-negative advanced breast cancer. Ann Oncol. 2018;29(7):1541-1547. doi: 10.1093/annonc/mdy155
5. Tripathy D, Im SA, Colleoni M, Franke F, Bardia A, Harbeck N, Hurvitz SA, Chow L, Sohn J, Lee KS, Campos-Gomez S, Villanueva Vazquez R, Jung KH, Babu KG, Wheatley-Price P, De Laurentiis M, Im YH, Kuemmel S, El-Saghir N, Liu MC, Carlson G, Hughes G, Diaz-Padilla I, Germa C, Hirawat S, Lu YS. Ribociclib plus endocrine therapy for premenopausal women with hormone-receptor-positive, advanced breast cancer (MONALEESA-7): a randomised phase 3 trial. Lancet Oncol. 2018;19(7):904-915. doi: 10.1016/S1470-2045(18)30292-4
6. Rugo HS, Finn RS, Diéras V, Ettl J, Lipatov O, Joy AA, Harbeck N, Castrellon A, Iyer S, Lu DR, Mori A, Gauthier ER, Bartlett CH, Gelmon KA, Slamon DJ. Palbociclib plus letrozole as first-line therapy in estrogen receptor-positive/human epidermal growth factor receptor 2-negative advanced breast cancer with extended follow-up. Breast Cancer Res Treat. 2019;174(3):719-729. doi: 10.1007/s10549-018-05125-4
7. Slamon DJ, Neven P, Chia S, Fasching PA, De Laurentiis M, Im SA, Petrakova K, Bianchi GV, Esteva FJ, Martín M, Nusch A, Sonke GS, De la Cruz-Merino L, Beck JT, Pivot X, Sondhi M, Wang Y, Chakravartty A, Rodriguez-Lorenc K, Taran T, Jerusalem G. Overall survival with ribociclib plus fulvestrant in advanced breast cancer. N Engl J Med. 2020;382:514-524. doi: 10.1056/NEJMoa1911149
8. Johnston S, O'Shaughnessy J, Martin M, Huober J, Toi M, Sohn J, André VAM, Martin HR, Hardebeck MC, Goetz MP. Abemaciclib as initial therapy for advanced breast cancer: MONARCH 3 up-dated results in prognostic subgroups. NPJ Breast Cancer. 2021;22;7(1):80. doi: 10.1038/s41523-021-00289-7
9. Abdallah HMA, Owoseni YI, Sultan A, Ahmed S, Wood J, Varadhan B, Ayodele O. 448P Real-world experience with CDK4/6 inhibitors for HR+/HER2-metastatic breast cancer (MBC). Ann Oncol. 2023;34(2):S369-S370. doi: 10.1016/j.annonc.2023.09.624
10. Miron AI, Anghel AV, Barnonschi AA, Mitre R, Liscu HD, Găinariu E, Pătru R, Coniac S. Real-World Outcomes of CDK4/6 Inhibitors Treatment in Metastatic Breast Cancer in Romania. Diagnostics (Basel). 2023;13(11):1938. doi: 10.3390/diagnostics13111938
11. Chen BF, Tsai YF, Chao TC, Lien PJ, Lin YS, Feng CJ, Chen YJ, Cheng HF, Liu CY, Lai JI, Tseng LM, Huang CC. Real-world experience with CDK4/6 inhibitors in hormone receptor-positive metastatic and recurrent breast cancer: findings from an Asian population. Clin Exp Med. 2024;24(1):185. doi: 10.1007/s10238-024-01458-1
12. Gehrchen ML, Berg T, Garly R, Jensen MB, Eßer-Naumann S, Rønlev JD, Nielsen HM, Knoop A, Kümler I. Real-world effectiveness of CDK 4/6 inhibitors in estrogen-positive metastatic breast cancer. BJC Rep. 2024;2(1):44. doi: 10.1038/s44276-024-00070-w
13. Plavetic ND, Čular K, Gudelj D, Kaceljak K, Križić M, Popovic M, Bulimbašić S, Sirotković-Skerlev M, Bubanović S, Silovski T. Real-world comparison of the efficacy of three CDK4/6 inhibitors (CDK4/6i) in the first-line treatment of endocrine-sensitive advanced breast cancer (aBC): Single institution experience. J Clin Oncol. 2024;42(16):e13080-e13080. doi: 10.1200/JCO.2024.42.16_suppl.e13080
14. Patel R, Mathews J, Hamm C, Kulkarni S, Gupta R, Opperman T, Chiong JD, Nasser A. Real-World Experience with CDK4/6 Inhibitors in the first-line palliative setting for HR+/HER2- advanced breast cancer. Curr Oncol. 2025;32(1):52. doi: 10.3390/curroncol32010052
15. Rugo HS, Layman RM, Lynce F, Liu X, Li B, McRoy L, Cohen AB, Estevez M, Curigliano G, Brufsky A. Comparative overall survival of CDK4/6 inhibitors plus an aromatase inhibitor in HR+/HER2- metastatic breast cancer in the US real-world setting. ESMO Open. 2025;10(1):104103 doi: 10.1016/j.esmoop.2024.104103
16. Клинические рекомендации Минздрава России. Рак молочной железы. 2021. Электронный ресурс. https://oncology-association.ru/wp-content/uploads/2021/02/rak-molochnoj-zhelezy-2021.pdf (Дата последнего доступа: 19. 05. 2025).
17. Тюляндин С.А., Артамонова Е.В., Жигулев А.Н., Жукова Л.Г., Королева И.А., Пароконная А.А., Семиглазова Т.Ю., Стенина М.Б., Фролова М.А. Рак молочной железы. Практические рекомендации RUSSCO, часть 1.2. Злокачественные опухоли. 2024;14(3s2):32–81. doi: 10.18027/2224-5057-2024-14-3s2-1.2-01
18. Cardoso F, Paluch-Shimon S, Schumacher-Wulf E, Matos L, Gelmon K, Aapro MS, Bajpai J, Barrios CH, Bergh J, Bergsten-Nordström E, Biganzoli L, Cardoso MJ, Carey LA, Chavez-MacGregor M, Chidebe R, Cortés J, Curigliano G, Dent RA, El Saghir NS, Eniu A, Fallowfield L, Francis PA, Franco Millan SX, Gilchrist J, Gligorov J, Gradishar WJ, Haidinger R, Harbeck N, Hu X, Kaur R, Kiely B, Kim SB, Koppikar S, Kuper-Hommel MJJ, Lecouvet FE, Mason G, Mertz SA, Mueller V, Myerson C, Neciosup S, Offersen BV, Ohno S, Pagani O, Partridge AH, Penault-Llorca F, Prat A, Rugo HS, Senkus E, Sledge GW, Swain SM, Thomssen C, Vorobiof DA, Vuylsteke P, Wiseman T, Xu B, Costa A, Norton L, Winer EP. 6<sup>th</sup> and 7<sup>ер</sup> International consensus guidelines for the management of advanced breast cancer (ABC guidelines 6 and 7). The Breast. 2024;76:103756. doi: 10.1016/j.breast.2024.103756
19. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Breast Cancer Version 3.2025 Invasive Breast Cancer. Электронный ресурс. https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf (Дата последнего доступа: 26. 03. 2025)
20. Золотой стандарт профилактики, диагностики, лечения и реабилитации больных РМЖ 2025. Электронный ресурс. https://docs.google.com/document/d/14XU19rSHmmg0v8aL9msY9B1uoscVK7WS/edit#heading=h.gjdgxs (Дата последнего доступа: 19. 05. 2025)
21. Sledge GW Jr, Toi M, Neven P, Sohn J, Inoue K, Pivot X, Burdaeva O, Okera M, Masuda N, Kaufman PA, Koh H, Grischke EM, Conte P, Lu Y, Barriga S, Hurt K, Frenzel M, Johnston S, Llombart-Cussac A. The effect of abemaciclib plus fulvestrant on overall survival in hormone receptor-positive, ERBB2-negative breast cancer that progressed on endocrine therapy – MONARCH 2. A randomized clinical trial. JAMA Oncol. 2020;6(1):116–124. doi: 10.1001/jamaoncol.2019.4782
22. Cristofanilli M, Rugo HS, Im SA, Slamon DJ, Harbeck N, Bondarenko I, Masuda N, Colleoni M, DeMichele A, Loi S, Iwata H, O'Leary B, André F, Loibl S, Bananis E, Liu Y, Huang X, Kim S, Lechuga Frean MJ, Turner NC. Overall survival (OS) with palbociclib (PAL) + fulvestrant (FUL) in women with hormone receptor–positive (HR+), human epidermal growth factor receptor 2–negative (HER2–) advanced breast cancer (ABC): Updated analyses from PALOMA-3. J Clin Oncol. 2021;39:15_suppl:1000-1000. doi: 10.1200/JCO.2021.39.15_suppl.1000
23. Hortobagyi GN, Stemmer SM, Burris HA, Yap YS, Sonke GS, Hart L, Campone M, Petrakova K, Winer EP, Janni W, Conte PF, Cameron D, André F, Arteaga C, Zarate JP, Chakravartty A, Taran T, Le Gac F, Serra P, O'Shaughnessy J. Overall survival (OS) results from the phase III MONALEESA-2 (ML-2) trial of postmenopausal patients (pts) with hormone receptor positive/human epidermal growth factor receptor 2 negative (HR+/HER2−) advanced breast cancer (ABC) treated with endocrine therapy (ET) ± ribociclib (RIB). Ann Oncol. 2021;32(suppl_5):S1283-S1346. doi: 10.1016/annonc/annonc741
24. Tripathy D, Im S-A, Colleoni M, Franke F, Bardia A, Harbeck N, Hurvitz S, Chow L, Sohn J, Lee KS, Campos-Gomez S, Vazquez RV, Jung KH, Babu KG; Wheatley-Price P, De Laurentiis M, Im Y-H, Kümmel S, El-Saghir N, Liu M-C, Kaur S, Gasch C, Wang C, Wang Y, Chakravartty A, Luet Y-S. Updated overall survival (OS) results from the phase III MONALEESA-7 trial of pre- or perimenopausal patients with HR+/HER2- advanced breast cancer (ABC) treated with endocrine therapy (ET) ± ribociclib. Cancer Res. 2021;81(4_Suppl):PD2-04. doi: 10.1158/1538-7445.SABCS20-PD2-04
25. Finn RS, Rugo HS, Dieraset VC, Harbeck N, Im S-A, Gelmon KA, Walshe JM, Martin M, Mac Gregor MC, Bananis E, Gauthier ERd, Lu DR, Kim S, Slamon DJ. Overall survival (OS) with first-line palbociclib plus letrozole (PAL+LET) versus placebo plus letrozole (PBO+LET) in women with estrogen receptor–positive/human epidermal growth factor receptor 2–negative advanced breast cancer (ER+/HER2− ABC): Analyses from PALOMA-2. J Clin Oncol. 2022;40(17_suppl):LBA1003. doi: 10.1200/JCO.2022.40.17_suppl.LBA1003
26. Goetz MP, Toi M, Huober J, Sohn J, Trédan O, Park IH, Campone M, Chen SC, Manso LM, Paluch-Shimon S, Freedman OC, O'Shaughnessy J, Pivot X, Tolaney SM, Hurvitz SA, Llombart-Cussac A, André V, Saha A, van Hal G, Shahir A, Iwata H, Johnston SRD. Abemaciclib plus a nonsteroidal aromatase inhibitor as initial therapy for HR+, HER2- advanced breast cancer: final overall survival results of MONARCH 3. Ann Oncol. 2024;35(8):718-727. doi: 10.1016/j.annonc.2024.04.013
27. Slamon DJ, Diéras V, Rugo HS, Harbeck N, Im SA, Gelmon KA, Lipatov ON, Walshe JM, Martin M, Chavez-MacGregor M, Bananis E, Gauthier E, Lu DR, Kim S, Finn RS. Overall survival with palbociclib plus letrozole in advanced breast cancer. J Clin Oncol. 2024;42(9):994-1000. doi: 10.1200/JCO.23.00137
28. Государственный Реестр Лекарственных Средств (ГРЛС). Электронный ресурс. https://grls.rosminzdrav.ru/default.aspx (Дата последнего доступа: 23. 02. 2025).
Об авторах
И. Е. ХатьковРоссия
Игорь Евгеньевич Хатьков, д. м. н., профессор, академик РАН, зав. кафедрой, директор ГБУЗ, главный
внештатный специалист-онколог департамента
здравоохранения Москвы, председатель РОО «Московское онкологическое общество»
лечебный факультет; кафедра факультетской хирургии № 2
Москва
И. И. Андреяшкина
Россия
Ирина Ивановна Андреяшкина, д. м. н., зам. главного внештатного специалиста-онколога департамента здравоохранения Москвы, в. н. с.
отдел общей онкологии
Москва
И. Д. Троценко
Россия
Иван Дмитриевич Троценко, к. м. н., с. н. с., исполнительный директор РОО
отдел общей онкологии
Москва
О. Н. Матвеева
Россия
Ольга Николаевна Матвеева, к. м. н., медицинский руководитель направления Солидные опухоли
Москва
В. А. Резников
Россия
Валерий Анатольевич Резников, старший медицинский советник направления Солидные опухоли
Москва
Рецензия
Для цитирования:
Хатьков И.Е., Андреяшкина И.И., Троценко И.Д., Матвеева О.Н., Резников В.А. СТАТЬЯ ОТОЗВАНА: Исследование ICEDORA: клинико-демографическая характеристика и схемы лечения пациентов с HR+ HER2- местнораспространённым или метастатическим раком молочной железы, принимающих ингибиторы CDK4/6, в реальной клинической практике. Реальная клиническая практика: данные и доказательства. 2025;5(2):83-100. https://doi.org/10.37489/2782-3784-myrwd-076. EDN: EFAKGL
For citation:
Khatkov I.E., Andreyashkina I.I., Trotsenko I.D., Matveeva O.N., Reznikov V.A. RETRACTED: The ICEDORA study: clinical and demographic characteristics and treatment regimens of patients with HR+ HER2- locally advanced or metastatic breast cancer receiving CDK4/6 inhibitors in real clinical practice. Real-World Data & Evidence. 2025;5(2):83-100. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-076. EDN: EFAKGL
JATS XML






























