Перейти к:
Перспективы применения индивидуализированного интегрального анализа нежелательных явлений при клинических исследованиях вакцин
https://doi.org/10.37489/2782-3784-myrwd-080
EDN: UNSHEV
Аннотация
Введение. Данная работа является продолжением изучения безопасности лекарственной терапии в клинических исследованиях, в рамках которого был предложен алгоритм принятия решений на основе метода количественного интегрального анализа нежелательных явлений (НЯ). Для внедрения разработанного алгоритма в клиническую практику необходима его апробация на различных группах лекарственных средств. В качестве препарата для тестирования выбраны вакцины для активной профилактики вирусного гепатита А. Полученные результаты могут стать основой для оценки возможностей метода при формировании прогноза развития неблагоприятных реакций в процессе вакцинопрофилактики.
Цель. Определение эффективности и перспективных направлений применения индивидуализированного интегрального анализа нежелательных явлений по результатам клинических испытаний на примере вакцин для активной профилактики вирусного гепатита А.
Материалы и методы. Индивидуализированная интегральная оценка НЯ выполнена с использованием алгоритма, основные этапы которого подробно представлены в предыдущих работах авторов, по результатам клинических исследований безопасности и иммуногенности вакцины против вирусного гепатита А, проведённых в соответствии с регуляторными и этическими требованиями Российской Федерации. На этапе определения весовых коэффициентов был осуществлён экспертный опрос для оценки важности отдельных характеристик НЯ с использованием метода анализа иерархий. Математико-статистический анализ индивидуализированных интегральных оценок проводили с использованием валидированного программного обеспечения. Для решения задачи оценки информативности и дискриминационной значимости гендерно-возрастных и клинико-лабораторных показателей с целью последующего прогноза возможного развития неблагоприятных отклонений в состоянии здоровья использовали модуль GDA — Общие модели дискриминантного анализа.
Результаты. В процессе реализации основных этапов количественного интегрального анализа НЯ по результатам клинического исследования вакцин для профилактики вирусного гепатита А на системно-органном и организменном уровнях получены данные, свидетельствующие об отсутствии необходимости дополнительной экспертной оценки или повторного проведения исследования этого препарата. Установленная в настоящей работе частота встречаемости нежелательных реакций по отдельным органам и системам была выше уровня для аналогичных вакцин, приведённых в протоколе исследования. С использованием дискриминантного анализа проведена оценка информативности от- дельных гендерно-возрастных и клинико-лабораторных показателей, полученных во время скрининга добровольцев, для разделения групп лиц с повышенной и умеренной индивидуальной чувствительностью к введению вакцин для профилактики вирусного гепатита А. Установлено, что только 8 из 37 показателей вносили статистически значимый вклад в разделение анализируемых групп. Изучаемые показатели имели низкую информативность, что свидетельствует о недостаточной специфичности признаков среди данных скринингового обследования для прогноза развития неблагоприятных отклонений в состоянии здоровья. Общий уровень дискриминации анализируемых групп на основе данных скринингового обследования добровольцев составил около 79 %. Доля правильной классификации группы лиц с повышенной индивидуальной чувствительностью к введению препарата составила 63 %.
Выводы. Разработанный и апробированный на примере вакцин для профилактики вирусного гепатита А метод количественного интегрального анализа НЯ показал перспективность его применения для выделения лиц с повышенной индивидуальной чувствительностью в ходе вакцинопрофилактики на основе исходных гендерно-возрастных, демографических и клинико-лабораторных показателей. Дальнейшие исследования планируется проводить на объединенных данных о нежелательных реакциях при применении вакцин со сходными органоспецифическими и системными нарушениями как в ходе клинических исследований, так и по данным автоматизированной информационной системы «Фармаконадзор», а также путём расширения методов математико-статистической обработки данных, включая нейросетевой анализ.
Ключевые слова
Для цитирования:
Верведа А.Б., Сыраева Г.И., Василюк В.Б., Фарапонова М.В. Перспективы применения индивидуализированного интегрального анализа нежелательных явлений при клинических исследованиях вакцин. Реальная клиническая практика: данные и доказательства. 2025;5(3):21-37. https://doi.org/10.37489/2782-3784-myrwd-080. EDN: UNSHEV
For citation:
Verveda A.B., Syraeva G.I., Vasilyuk V.B., Faraponova M.V. Prospects for the application of individualized integrated analysis of adverse events in vaccine clinical trials. Real-World Data & Evidence. 2025;5(3):21-37. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-080. EDN: UNSHEV
Введение / Introduction
Ранее нами была разработана методика углублённого изучения безопасности фармакотерапии на основе количественного интегрального анализа нежелательных явлений (НЯ), которая представляет собой пятиэтапную индивидуализированную оценку выявленных нежелательных реакций в клинических исследованиях [1]. Апробация разработанного подхода на основе результатов клинических исследований препарата с международным непатентованным наименованием (МНН) трастузумаб позволила подтвердить его эффективность, а также сделать заключение о возможности прогнозирования безопасность назначаемой фармакотерапии, и, в перспективе, перейти к риск-ориентированному подходу при применении данного лекарственного средства на пострегистрационном этапе [2].
Продолжение использования разработанного методического подхода при анализе результатов клинических исследований вакцин обусловлено следующим обстоятельством. Проведённая нами апробация представленного алгоритма в ходе клинических исследований I фазы на примере МНН трастузумаб связана с ключевой особенностью данного этапа — привлечение, как правило, здоровых добровольцев. Использование результатов обследования данного контингента лиц позволяет с высокой долей уверенности утверждать, что выявленные в ходе исследования НЯ связаны преимущественно с анализируемым лекарственным средством, а не с множеством других факторов, которые необходимо учитывать при изучении препарата на пациентах в более поздних фазах (степень тяжести, сопутствующие болезни и ряд других факторов). Однако однократный приём препарата по умолчанию приводит к развитию гораздо меньшего количества НЯ, чем курсовое применение в ходе клинических исследований II–IV фаз на пациентах, что потребует модификации разработанного метода для учёта влияния множества стратифицирующих факторов.
В то же время в ходе клинических исследований вакцин, включая III фазу, дозовые нагрузки в большинстве случаев сопоставимы с аналогичными дозами при вакцинации населения и проводятся на здоровых добровольцах, что позволяет использовать разработанный метод без дополнительной модификации для оценки его возможностей при формировании прогноза развития неблагоприятных реакций в процессе вакцинопрофилактики.
Цель работы / Objective
Определение эффективности и перспективных направлений применения индивидуализированного интегрального анализа НЯ по результатам клинических испытаний на примере вакцин для активной профилактики вирусного гепатита А.
Материалы и методы / Materials and methods
В настоящем исследовании проведена индивидуализированная интегральная оценка НЯ, основные этапы которой подробно представлены в наших предыдущих работах [1][2], по результатам клинических исследований безопасности и иммуногенности вакцины против вирусного гепатита А, проведённых в соответствии с регуляторными и этическими требованиями Российской Федерации.
На этапе определения весовых коэффициентов был осуществлён экспертный опрос для оценки важности отдельных характеристик нежелательных явлений с использованием метода анализа иерархий (МАИ) [3]. Методология МАИ была реализована экспертами — членами Независимого Комитета по мониторингу данных (НКМД / Independent Data Monitoring Committee), организованного на базе ООО «Научно-исследовательский центр Эко-безопасность».
Математико-статистический анализ результатов осуществляли с использованием пакетов R 4.4.0 и Statistica 10.0, а также Microsoft Excel 2013 для построения таблиц.
Рассчитывали следующие описательные статистики интегральных групповых показателей НЯ — среднее арифметическое (M), стандартное отклонение (SD), медиана (Me), верхняя (UQ) и нижняя (LQ) квартили. Также приводили численность группы (N), минимальные (Min) и максимальные (Max) значения показателя. Частоты встречаемости в тексте представлены в виде абсолютной частоты (n), относительной частоты (%), а также приведена численность группы (N).
Для решения задачи оценки информативности гендерно-возрастных и клинико-лабораторных показателей с целью последующего прогноза возможного развития неблагоприятных отклонений в состоянии здоровья использовали дискриминантный анализ (ДА). Дискриминацию проводили между группами: «низкая вероятность развития НЯ» (НВР НЯ), «возможно развитие НЯ» (ВР НЯ) и «высокая вероятность развития НЯ» (ВВР НЯ), сформированных с использованием разработанной методики. Ввиду того, что не все признаки отвечали критерию нормальности, а также анализировали качественные переменные (пол), был использован непараметрический вариант дискриминантного анализа, представленный в модуле GDA — Общие модели дискриминантного анализа (ОМДА) программы STATISTICA 10.0 [4]. Дискриминантный анализ выполняли с оценкой всех эффектов при построении модели. В качестве критериев для отбора информативных дискриминантных переменных применяли статистику частная лямбда Уилкса (ЧЛУ). Значение ЧЛУ может изменяться от 1,0 (нет никакой дискриминации) до 0,0 (полная дискриминация), т. е. чем меньше ЧЛУ, тем информативность показателя выше. Дополнительно оценивали уровень F-критерия — чем больше значение, тем больше вклад эффекта в процедуру дискриминации. Также с использованием ОМДА были рассчитаны функции классификации и построены матрицы классификации выборок, позволяющие оценить эффективности классификации по совокупности всех анализируемых гендерно-возрастных и клинико-лабораторных показателей.
- Реализация основных этапов метода количественного интегрального анализа при оценке безопасности вакцин для профилактики вирусного гепатита А
Дизайн исследования был разработан с учётом российских рекомендаций по проведению исследований третьей фазы [5][6][7].
В рамках исследования производилась оценка иммуногенности и безопасности вакцины против вирусного гепатита А (ВГА) путём определения анти-ВГА антител у добровольцев от 18 до 59 лет при её двукратном введении. Дизайн исследования соответствовал требованиям к клиническим исследованиям вакцин, изложенным в руководстве по проведению клинических исследований лекарственных препаратов (ФГБУ «НЦЭСМП» Минздрава России, том 2, глава 5, 2012 г.), а также в руководстве Европейского агентства лекарственных средств по проведению клинических исследований вакцин. Было проведено рандомизированное двойное слепое сравнительное исследование в параллельных группах. Оценивался профиль безопасности вакцины как с точки зрения референтного препарата, так и с точки зрения препарата сравнения, т. е. параметры безопасности были объединены в ключе оценки интегрального анализа.
Количественный интегральный анализ безопасности включал 5 основных этапов.
Этап 1 — присвоение каждой из характеристик НЯ балльной оценки.
В ходе клинического исследования по оценке безопасности и иммуногенности вакцины против ВГА в соответствии с протоколом были оценены следующие характеристики НЯ: серьёзность, тяжесть проявления («тяжесть»), наличие связи с исследуемым препаратом («связь»), предпринятые меры в отношении НЯ («лечение»), предпринятые меры в отношении препарата («препарат») и исход явления («исход»). Дополнительно к требованиям протокола в настоящем исследовании анализировали общее количество НЯ у одного добровольца («количество НЯ»), количество общих постинъекционных реакций («количество ОР») и количество местных постинъекционных реакций («количество МР»). Принимая во внимание, что в ходе клинического исследования СНЯ не были зарегистрированы, а в качестве описания характеристики «препарат» приведены только две категории «приём препарата продолжен по запланированной протоколом схеме» и «не применимо», что свидетельствует об отсутствии её дискриминативной способности, представленная характеристика не была включена в дальнейший анализ.
Присвоенные унифицированные балльные оценки для каждой из анализируемых характеристик, ранжированные по порядку возрастания уровня потенциального неблагоприятного воздействия на организм, приведены в таблице 1. Для описания характеристики НЯ добровольцев, у которых нежелательные явления не зарегистрированы, введена категория «отсутствует».
|
Таблица 1. Балльные оценки характеристик нежелательных явлений по результатам клинических исследований вакцины против вирусного гепатита А Table 1. Scores for characteristics of adverse events based on the results of clinical trials of the anti-HAV vaccine |
||
|
Характеристика НЯ/ |
Описание характеристики/ |
Балльная оценка/Score |
|
Тяжесть/Severity |
Отсутствует/Not available |
3 балла/points |
|
Лёгкая/Mild |
2 балла/points |
|
|
Умеренная/Moderate |
1 балл/point |
|
|
Связь/Relation |
Отсутствует/None |
7 баллов/points |
|
Неклассифицируемая/Unclassifiable |
6 баллов/points |
|
|
Условная/Conditional |
5 баллов/points |
|
|
Сомнительная/Remote |
4 балла/points |
|
|
Возможная/Possible |
3 балла/points |
|
|
Вероятная/Probable |
2 балла/points |
|
|
Определённая/Certain |
1 балл/point |
|
|
Лечение/Treatment |
Отсутствует/None |
3 балла/points |
|
Не предпринималось/Not available |
2 балла/points |
|
|
Медикаментозная терапия/Medication therapy |
1 балл/point |
|
|
Исход/Outcome |
Отсутствует/None |
3 балла/points |
|
НЯ разрешилось/AE resolved |
2 балла/points |
|
|
Не известно/Not known |
1 балл/point |
|
|
Количество НЯ/Quantity AE |
Отсутствует/None |
5 баллов/points |
|
1–3 НЯ/1–3 AE |
4 балла/points |
|
|
4–6 НЯ/4–6 AEs |
3 балла/points |
|
|
7–9 НЯ/7–9 AEs |
2 балла/points |
|
|
10 и более НЯ/10 and more AEs |
1 балл/point |
|
|
Количество ОР/Quantity GR |
Отсутствует/None |
5 баллов/points |
|
1–3 НЯ/1–3 AE |
4 балла/points |
|
|
4–6 НЯ/4–6 AEs |
3 балла/points |
|
|
7–9 НЯ/7–9 AEs |
2 балла/points |
|
|
10 и более НЯ/10 and more AEs |
1 балл/point |
|
|
Количество МР/Quantity LR |
Отсутствует/None |
4 балла/points |
|
1–3 НЯ/1–3 AE |
3 балла/points |
|
|
4–6 НЯ/4–6 AEs |
2 балла/points |
|
|
7–9 НЯ/7–9 AEs |
1 балл/point |
|
Этап 2 — преобразование балльных оценок в нормированную количественную шкалу.
Для преобразование балльных оценок в нормированную количественную шкалу [0][1] использовали перевод порядковых признаков в нечёткое число с помощью аппарата теории нечётких множеств и применение функций принадлежности (ФП) нечётких множеств [8]. Для построения ФП использовали апостериорный подход [9]. На основе процедур, представленных в работе [10], строили трапециевидные ФП для каждого из уровней (баллов) характеристик НЯ. Трапециевидная ФП описывается четырьмя основными точками: µ (х) = (k1, k2, k3, k4), где k2 и k3 — граничные значения интервала, на котором ФП принимает значение, равное 1, а точки k1 и k4 — левый и правый нуль функции, соответственно.
Результаты построения трапециевидных ФП для различных уровней (баллов) основных характеристик НЯ представлены в таблице 2.
|
Таблица 2. Основные точки ФП балльных оценок характеристик НЯ Table 2. Main points of membership functions of scores for AE characteristics |
|||
|
Характеристика НЯ/Characteristics of AEs |
Балльная оценка/Score |
Частота встречаемости/Occurrence Frequency |
Координаты точек ФП/Coordinates (k1, k2, k3, k4) |
|
Тяжесть/Severity |
3 балла/points |
0,140 |
(0,790; 0,930; 1,000; 1,000) |
|
2 балла/points |
0,794 |
(0,033; 0,099; 0,790; 0,930) |
|
|
1 балл/point |
0,066 |
(0,000; 0,000; 0,033; 0,099) |
|
|
Связь/Relation |
7 баллов/points |
0,140 |
(0,859; 0,860; 1,000; 1,000) |
|
6 баллов/points |
0,001 |
(0,857; 0,859; 0,859; 0,860) |
|
|
5 баллов/points |
0,003 |
(0,854; 0,857; 0,857; 0,859) |
|
|
4 балла/points |
0,040 |
(0,795; 0,835; 0,854; 0,857) |
|
|
3 балла/points |
0,093 |
(0,676; 0,769; 0,795; 0,835) |
|
|
2 балла/points |
0,222 |
(0,389; 0,611; 0,676; 0,769) |
|
|
1 балл/point |
0,500 |
(0,000; 0,000; 0,389; 0,611) |
|
|
Характеристика НЯ/Characteristics of AEs |
Балльная оценка/Score |
Частота встречаемости/Occurrence frequency |
Координаты точек ФП/Coordinates (k1, k2, k3, k4) |
|
Лечение/Treatment |
3 балла/points |
0,140 |
(0,790; 0,930; 1,000; 1,000) |
|
2 балла/points |
0,839 |
(0,010; 0,031; 0,790; 0,930) |
|
|
1 балл/point |
0,021 |
(0,000; 0,000; 0,010; 0,031) |
|
|
Исход/Outcome |
3 балла/points |
0,140 |
(0,790; 0,930; 1,000; 1,000) |
|
2 балла/points |
0,858 |
(0,001; 0,002; 0,790; 0,930) |
|
|
1 балл/point |
0,001 |
(0,000; 0,000; 0,001; 0,002) |
|
|
Количество НЯ/Quantity AE |
5 баллов/points |
0,420 |
(0,431; 0,730; 1,000; 1,000) |
|
4 балла/points |
0,299 |
(0,208; 0,355; 0,431; 0,730) |
|
|
3 балла/points |
0,147 |
(0,100; 0,167; 0,208; 0,355) |
|
|
2 балла/points |
0,067 |
(0,033; 0,100; 0,100; 0,167) |
|
|
1 балл/point |
0,067 |
(0,000; 0,000; 0,033; 0,100) |
|
|
Количество ОР/Quantity GR |
5 баллов/points |
0,585 |
(0,290; 0,540; 1,000; 1,000) |
|
4 балла/points |
0,250 |
(0,116; 0,214; 0,290; 0,540) |
|
|
3 балла/points |
0,098 |
(0,047; 0,087; 0,116; 0,214) |
|
|
2 балла/points |
0,040 |
(0,013; 0,040; 0,047; 0,087) |
|
|
1 балл/point |
0,027 |
(0,000; 0,000; 0,013; 0,040) |
|
|
Количество МР/Quantity LR |
4 балла/points |
0,589 |
(0,239; 0,583; 1,000; 1,000) |
|
3 балла/points |
0,344 |
(0,036; 0,098; 0,239; 0,583) |
|
|
2 балла/points |
0,063 |
(0,002; 0,007; 0,036; 0,098) |
|
|
1 балл/point |
0,004 |
(0,000; 0,000; 0,002; 0,007) |
|
Примечания: НЯ — нежелательное явление; ОР — общие реакции; МР — местные реакции; ФП — функция принадлежности.
Notes: AE — Adverse Event; GR — General reactions; LR — Local reactions.
Для получения из ФП количественных показателей (четкой оценки) балла проведена процедура дефаззификации центроидным способом по следующей формуле:
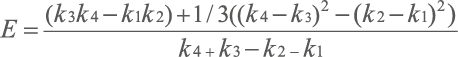
Полученные чёткие оценки (центроид Е) подверглись процедуре нормализации с использованием способа «отношение» (деление исходных значений на максимальное значение Е) [11]. В результате нормализации данные, имеющие максимальный балл (7 баллов или 5 баллов и так далее), т. е. отнесённые к категории «отсутствует», получили числовую оценку «1» (таблица 3).
|
Таблица 3. Результаты преобразования ФП балльных оценок в нормализованные значения на отрезке [0, 1] Table 3. Results of transforming membership functions of point estimates into normalized values on the segment [0, 1] |
|||
|
Характеристика НЯ/Characteristics of AEs |
Балльная оценка/Score |
Центроид/Center Е |
Нормализованная четкая оценка/Normalized clear evaluation (En) |
|
Тяжесть/Severity |
3 балла/points |
0,924 |
1,000 |
|
2 балла/points |
0,463 |
0,501 |
|
|
1 балл/point |
0,035 |
0,038 |
|
|
Связь/Relation |
7 баллов/points |
0,930 |
1,000 |
|
6 баллов/points |
0,859 |
0,924 |
|
|
5 баллов/points |
0,857 |
0,921 |
|
|
4 балла/points |
0,833 |
0,896 |
|
|
3 балла/points |
0,766 |
0,823 |
|
|
Характеристика НЯ/Characteristics of AEs |
Балльная оценка/Score |
Центроид/Center Е |
Нормализованная четкая оценка/Normalized clear evaluation (En) |
|
Связь/Relation |
2 балла/points |
0,604 |
0,649 |
|
1 балл/point |
0,254 |
0,273 |
|
|
Лечение/Treatment |
3 балла/points |
0,924 |
1,000 |
|
2 балла/points |
0,441 |
0,477 |
|
|
1 балл/point |
0,011 |
0,012 |
|
|
Исход/Outcome |
3 балла/points |
0,924 |
1,000 |
|
2 балла/points |
0,432 |
0,467 |
|
|
1 балл/point |
0,001 |
0,001 |
|
|
Количество НЯ/Quantity AE |
5 баллов/points |
0,782 |
1,000 |
|
4 балла/points |
0,440 |
0,563 |
|
|
3 балла/points |
0,212 |
0,272 |
|
|
2 балла/points |
0,100 |
0,129 |
|
|
1 балл/point |
0,036 |
0,046 |
|
|
Количество ОР/Quantity GR |
5 баллов/points |
0,703 |
1,000 |
|
4 балла/points |
0,299 |
0,425 |
|
|
3 балла/points |
0,119 |
0,170 |
|
|
2 балла/points |
0,048 |
0,068 |
|
|
1 балл/point |
0,014 |
0,021 |
|
|
Количество МР/Quantity LR |
4 балла/points |
0,697 |
1,000 |
|
3 балла/points |
0,252 |
0,362 |
|
|
2 балла/points |
0,038 |
0,055 |
|
|
1 балл/point |
0,002 |
0,003 |
|
Примечания: НЯ — нежелательное явление; ОР — общие реакции; МР — местные реакции; ФП — функция принадлежности.
Notes: AE — Adverse Event; GR — General reactions; LR — Local reactions.
Этап 3 — определение весовых коэффициентов характеристик НЯ.
Для определения весовых коэффициентов характеристик НЯ была организована процедура экспертного опроса. В опросе принимали участие 6 экспертов — членов НКМД, организованного на базе ООО «Научно-исследовательский центр Эко-безопасность». Оценку информативности (весовых коэффициентов) каждой характеристики НЯ осуществляли методом парных сравнений (тест Саати) [3].
Результатом проведения расчётов являлось получение весовых коэффициентов для характеристик НЯ (нормализованный собственный вектор матрицы парных сравнений). Пропорциональность предпочтений каждого эксперта оценивали на основе отношения согласованности (ОС), которое для всех экспертов было менее 10 %.
Результаты усреднения данных (среднее геометрическое значение) экспертного опроса представлены в таблице 4.
|
Таблица 4. Результаты оценки информативности (веса) анализируемых характеристик НЯ Table 4. Results of assessing the information content (weight) of the analyzed characteristics of AEs |
|
|
Характеристика НЯ/Characteristics of AEs |
Вес/ Weight (ωi) |
|
Количество НЯ/Quantity AE |
0,359 |
|
Количество ОР/Quantity GR |
0,234 |
|
Количество МР/Quantity LR |
0,163 |
|
Лечение/Treatment |
0,108 |
|
Тяжесть/Severity |
0,075 |
|
Связь/Relation |
0,036 |
|
Исход/Outcome |
0,025 |
Примечания: НЯ — нежелательное явление; ОР — общие реакции; МР — местные реакции.
Notes: AE — Adverse Event; GR — General reactions; LR — Local reactions.
Этап 4 — агрегация данных для получения интегрального показателя на системно-органном и организменном уровнях.
Всего в ходе исследования было установлено 576 НЯ, которые были классифицированы по органам и системам с использованием SOC MedDRA (версия 27.0).
Для получения системного интегрального показателя (WS) балльных оценок всех характеристик каждого НЯ проводили интеграцию взвешенных (ωi) нормализованных чётких оценок балла (Eni), соответствующих установленной характеристике НЯ, по следующей формуле:
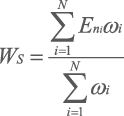 , где
, где
i — характеристика НЯ;
N — количество характеристик НЯ.
Если у одного добровольца были установлены несколько НЯ по одной из систем, для анализа оставляли одно явление с наиболее неблагоприятными характеристиками (Ws — минимальная). В результате дополнительного отбора из 576 НЯ для окончательного анализа были выделены 253 НЯ, которые были связаны: в 125 случаях (49,4 %) с общими нарушениями и реакциями в месте введения, в 41 случае (16,2 %) с нарушениями со стороны нервной системы, в 40 случаях (15,8 %) с нарушениями со стороны мышечной, скелетной и соединительной ткани, в 14 случаях (5,5 %) с инфекциями и инвазиями, в 14 случаях (5,5 %) с желудочно-кишечными нарушениями, в 13 случаях (5,2 %) с нарушениями со стороны дыхательной системы, в 2 случаях (0,8 %) с нарушениями метаболизма и питания, в 2 случаях (0,8 %) с нарушениями со стороны крови и лимфатической системы, в 1 случае (0,4 %) с психическими расстройствами и в 1 случае (0,4 %) с лабораторными и инструментальными данными. У 94 добровольцев НЯ не установлены.
Из 224 добровольцев, принимавших участие в исследовании, НЯ были установлены у 130 человек, что при общем количестве принятых к анализу НЯ (253) обусловило наличие нескольких НЯ по различным системам у отдельных добровольцев.
Для получения общего индивидуального интегрального показателя (WI), характеризующего побочные действия анализируемых препаратов на организменном уровне у одного добровольца, проводили интеграцию взвешенных (ωSi) системных показателей (WSi) по всем установленным системам по следующей формуле:
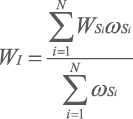 , где
, где
i — системы организма;
N — количество анализируемых систем у одного добровольца.
Примечание: SOC MedDRA — класс системы органов международного словаря нежелательных реакций, возникающих при применении лекарственных препаратов для медицинского применения.
Note: SOC MedDRA — System Organ Class of Medical Dictionary for Regulatory Activities.
Для получения весовых коэффициентов отдельных систем организма (ωSi) была проанализирована частота нежелательных реакций по отдельным системам организма — чем больше относительная частота встречаемости в настоящем исследовании, тем более «неблагоприятна» данная система и, соответственно, больше значение веса. Результаты оценки информативности анализируемых систем организма, полученные с использованием метода Фишберна [12], представлены в таблице 5.
|
Таблица 5. Результаты оценки информативности (веса) анализируемых систем организма Table 5. Results of assessing the information content (weight) of the analyzed body systems |
|
|
Органы и системы по SOC MedDRA (версия 27.0)/ |
Вес / Weight (ωSi) |
|
10018065 Общие нарушения и реакции в месте введения |
0,250 |
|
10029205 Нарушения со стороны нервной системы |
0,214 |
|
10028395 Нарушения со стороны мышечной, скелетной и соединительной ткани |
0,179 |
|
10021881 Инфекции и инвазии |
0,143 |
|
10017947 Желудочно-кишечные нарушения |
0,143 |
|
10038738 Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
0,107 |
|
10027433 Нарушения метаболизма и питания |
0,071 |
|
10005329 Нарушения со стороны крови и лимфатической системы |
0,071 |
|
10037175 Психические расстройства |
0,036 |
|
10022891 Лабораторные и инструментальные данные |
0,036 |
Этап 5 — интерпретация результатов для принятия решения на основе разработанных критериев и полученного уровня интегрального показателя.
Интерпретация индивидуальных показателей на системно-органном уровне.
Для принятия решения по результатам проведенного анализа индивидуальных показателей на системно-органном уровне использовали трехуровневую шкалу желательности Харрингтона (таблица 6), где Di — интегральный индивидуальный показатель.
|
Таблица 6. Соответствие диапазонов шкалы Харрингтона уровням интегральных и системных показателей и заключений о вероятности развития НЯ по каждому добровольцу Table 6. Correspondence of the ranges of the Harrington scale to the levels of integral and systemic indicators |
||
|
Диапазоны значений шкалы Харрингтона/Harrington scale ranges |
Характеристика уровня индивидуальной оценки/Characteristics of the level |
Заключение/Conclusion |
|
1,00 ≥ Di ≥ 0,37 |
Отсутствие отклонений/ |
Низкая вероятность развития НЯ/ |
|
0,37 > Di ≥ 0,20 |
Умеренные отклонения/ |
Возможно развитие НЯ/ |
|
Di < 0,20 |
Выраженные отклонения/ |
Высокая вероятность развития НЯ/ |
Примечания: НЯ — нежелательное явление; Di — интегральный индивидуальный показатель.
Notes: AE — Adverse Event; Di — integral individual indicator.
Применительно к настоящему исследованию интегральный индивидуальный показатель Di шкалы Харрингтона соответствует системному интегральному индивидуальному показателю (WS).
Заключение о вероятности развития НЯ на основе индивидуальных показателей было сделано на основании заключений по отдельным группам исследуемого препарата (ИП) и препарата сравнения (ПС) по критериям:
— «НЯ не выявлены», если:
а) 100 % в обоих группах — низкая вероятность развития НЯ;
б) 100 % в группе ИП — низкая вероятность развития НЯ, до 40 % в группе ПС — возможно развитие НЯ.
— «НЯ выявлены», если:
а) более 40 % в обоих группах — высокая вероятность развития НЯ;
б) более 40 % в группе ИП — высокая вероятность развития НЯ, независимо от количества добровольцев с высокой вероятностью развития НЯ в группе ПС;
в) более 40 % добровольцев группах ИП или ПС по одной из систем — высокая вероятность развития НЯ.
— «Неопределённый результат», если не соблюдены условия для случаев «НЯ не выявлены» и «НЯ выявлены».
В таблице 7 представлена характеристика частот встречаемости различных уровней интегральной оценки по системам организма (органоспецифические нарушения) исследуемого препарата и препарата сравнения.
|
Таблица 7. Характеристики частот встречаемости, n (%), различных уровней интегральной индивидуальной оценки по системам организма для анализируемых групп вакцин — исследуемого препарата (ИП) и препарата сравнения (ПС) Table 7. Characteristics of frequency of occurrence, n (%), of various levels of integral individual assessment by body system for the analytical vaccine groups — Investigational Drug / ID (Comparison Drug / CD) |
||||||
|
SOC MedDRA |
Уровни индивидуальной оценки |
Уровни индивидуальной оценки для ПС/Levels of individual assessment for CD (N=112) |
||||
|
Отсутствие отклонений/ |
Умеренные отклонения/ |
Выраженные отклонения/ |
Отсутствие отклонений/ |
Умеренные отклонения/ |
Выраженные отклонения/ |
|
|
Отсутствие НЯ/No AEs |
55 (49,1 %) |
0 (0,0 %) |
0 (0,0 %) |
39 (34,8 %) |
0 (0,0 %) |
0 (0,0 %) |
|
10018065 Общие нарушения и реакции в месте введения/ |
37 (33,0 %) |
14 (12,5 %) |
3 (2,7 %) |
46 (41,1 %) |
15 (13,4 %) |
10 (8,9 %) |
|
10028395 Нарушения со стороны мышечной, скелетной и соединительной ткани/Muscle, skeletal and connective tissue disorders |
8 (7,1 %) |
9 (8,0 %) |
2 (1,8 %) |
7 (6,3 %) |
9 (8,0 %) |
5 (4,5 %) |
|
10038738 Нарушения со стороны дыхательной системы, органов грудной клетки и средостения/Respiratory, thoracic and mediastinal disorders |
6 (5,4 %) |
3 (2,7 %) |
0 (0,0 %) |
1 (0,9 %) |
1 (0,9 %) |
2 (1,8 %) |
|
10029205 Нарушения со стороны нервной системы/Nervous system disorders |
6 (5,4 %) |
9 (8,0 %) |
2 (1,8 %) |
9 (8,0 %) |
9 (8,0 %) |
6 (5,4 %) |
|
10021881 Инфекции и инвазии/Infections and infestations |
2 (1,8 %) |
2 (1,8 %) |
1 (0,9 %) |
2 (1,8 %) |
5 (4,5 %) |
2 (1,8 %) |
|
10017947 Желудочно-кишечные нарушения/Gastrointestinal disorders |
2 (1,8 %) |
3 (2,7 %) |
1 (0,9 %) |
3 (2,7 %) |
4 (3,6 %) |
1 (0,9 %) |
|
10037175 Психические расстройства/Mental Disorders |
1 (0,9 %) |
0 (0,0 %) |
0 (0,0 %) |
0 (0,0 %) |
0 (0,0 %) |
0 (0,0 %) |
|
10005329 Нарушения со стороны крови и лимфатической системы/Blood and lymphatic system disorders |
1 (0,9 %) |
0 (0,0 %) |
0 (0,0 %) |
1 (0,9 %) |
0 (0,0 %) |
0 (0,0 %) |
|
10022891 Лабораторные и инструментальные данные/Laboratory and instrumental data |
0 (0,0 %) |
0 (0,0 %) |
0 (0,0 %) |
0 (0,0 %) |
1 (0,9 %) |
0 (0,0 %) |
|
10027433 Нарушения метаболизма и питания/Metabolic and nutritional disorders |
0 (0,0 %) |
0 (0,0 %) |
0 (0,0 %) |
2 (1,8 %) |
0 (0,0 %) |
0 (0,0 %) |
Анализ данных таблицы 7 показал наличие добровольцев с «выраженными отклонениями» по SOC MedDRA для препаратов ИП/ПС в следующих системах: «10018065 Общие нарушения и реакции в месте введения» — 2,7 %/8,9 %, «10028395 Нарушения со стороны мышечной, скелетной и соединительной ткани» — 1,8 %/4,5 %, «Нарушения со стороны дыхательной системы, органов грудной клетки и средостения» — 0 %/1,8 %, «10029205 Нарушения со стороны нервной системы» — 1,8 %/5,4 %, «10021881 Инфекции и инвазии» — 0,9 %/1,8 %, «10017947 Желудочно-кишечные нарушения» — 0,9 %/0,9 %. Общая доля лиц с высокой вероятностью развития НЯ по системам организма в группе ИП составила 8,0 %, в группе ПС — 23,2 %.
Численность добровольцев с «умеренными отклонениями» по всем анализируемым органам и системам составила 35,7 % в группе ИП и 39,3 % в группе ПС.
В соответствии с представленными критериями по результатам интерпретации индивидуальных показателей по системам организма было сделано заключение «Неопределенный результат», что свидетельствует о наличии у отдельных добровольцев неблагоприятных изменения в состоянии различных органов и систем, не требующих проведения дополнительных обследований для установления причинно-следственных связей с приёмом препаратов и позволяющих перейти к этапу оценки групповых показателей.
Примечания: SOC MedDRA — класс системы органов международного словаря нежелательных реакций, возникающих при применении лекарственных препаратов для медицинского применения; ИП — исследуемый препарат; НЯ — нежелательное явление; ПС — препарат сравнения.
Notes: AE — Adverse Event; CD–Comparison Drug; ID–Investigational Drug; SOC MedDRA — System Organ Class of Medical Dictionary for Regulatory Activities.
В таблице 8 представлена характеристика частот встречаемости различных уровней интегральной оценки на организменном уровне (общие нарушения) исследуемого препарата и препарата сравнения.
|
Таблица 8. Характеристики частот встречаемости, n (%), различных уровней интегральной индивидуальной оценки на организменном уровне для анализируемых групп вакцин — исследуемого препарата (ИП) и препарата сравнения (ПС) Table 8. Characteristics of the frequency of occurrence, n (%), of various levels of integral individual assessment |
||||||
|
Показатели Indicators |
Уровни индивидуальной оценки для ИП/ |
Уровни индивидуальной оценки для ПС/ |
||||
|
Отсутствие отклонений/ |
Умеренные отклонения/Moderate deviations |
Выраженные отклонения/Severe deviations |
Отсутствие отклонений/No deviations |
Умеренные отклонения/Moderate deviations |
Выраженные отклонения/Severe deviations |
|
|
Общие нарушения/General disorders |
95 (84,8 %) |
15 (13,4 %) |
2 (1,8 %) |
88 (78,6 %) |
15 (13,4 %) |
9 (8,0 %) |
В соответствии с представленными критериями по результатам интерпретации индивидуальных показателей на организменном уровне было сделано заключение «Неопределённый результат», аналогичное по содержательной части характеристике для органоспецифических нарушений, что определяет целесообразность продолжения анализа на основе оценки групповых показателей общих нарушений.
Интерпретация групповых показателей. Для принятия решения по результатам проведённого анализа групповых показателей использовали трёхуровневую шкалу желательности Харрингтона (таблица 9), где Dg — интегральный групповой показатель.
|
Таблица 9. Соответствие диапазонов шкалы Харрингтона уровням групповой оценки интегральных и системных показателей и заключений о вероятности развития НЯ по группе Table 9. Correspondence of the ranges of the Harrington scale to the levels of group assessment of integral and systemic indicators and conclusions about the probability of developing AE in the group |
||
|
Диапазоны значений шкалы Харрингтона/Harrington scale ranges |
Характеристика уровня групповой оценки/Characteristics of the level of group evaluation |
Заключение по группе/ |
|
1,00 ≥ Dg ≥ 0,37 |
В пределах референтных диапазонов/ |
Низкая вероятность развития НЯ/ |
|
0,37 > Dg ≥ 0,20 |
Незначительно выходящий |
Возможно развитие НЯ/ |
|
Dg < 0,20 |
Значительно выходящий |
Высокая вероятность развития НЯ/ |
Примечания: SOC MedDRA — класс системы органов международного словаря нежелательных реакций, возникающих при применении лекарственных препаратов для медицинского применения; ИП — исследуемый препарат; ПС — препарат сравнения.
Notes: CD–Comparison Drug; ID–Investigational Drug; SOC MedDRA — System Organ Class of Medical Dictionary for Regulatory Activities.
Примечания: НЯ — нежелательное явление; Dg — интегральный групповой показатель.
Notes: AE — Adverse Event; Dg — integral group indicator.
Заключение о вероятности развития НЯ на основе групповых показателей было сделано на основании заключений по отдельным группам исследуемого препарата (ИП) и препарата сравнения (ПС) по критериям:
— «НЯ не выявлены», если:
а) все группы — низкая вероятность развития НЯ;
б) группа ИП — низкая вероятность развития НЯ, группа ПС — возможно развитие НЯ.
— «НЯ выявлены», если:
а) все группы — высокая вероятность развития НЯ;
б) системные показатели групп ИП или ПС — высокая вероятность развития НЯ.
— «Неопределённый результат», если:
а) все группы — возможно развитие НЯ;
б) группа ПС — высокая вероятность развития НЯ, независимо от группового заключения группы ИП.
В таблице 10 представлена количественная интегральная оценка общих нарушений (организменный уровень) для групп ИП и ПС. Как медианные, так и средние групповые показатели относились к диапазону от 0,37 до 1,0, т. е. «находились в пределах референтных диапазонов», что в соответствии с представленными критериями позволило прийти к итоговому заключения по групповым показателям «Низкая вероятность развития НЯ». Необходимо отметить, что уровень медианных значений количественных характеристики НЯ в группе ИП был статистически значимо на 11 % (р=0,042) выше (более благоприятный уровень) в сравнении с группой ПС.
|
Таблица 10. Результаты групповой оценки общих нарушений на основе количественных характеристик НЯ Table 10. Results of group assessment of general disorders based on quantitative characteristics of AEs |
|||||||||
|
Группа |
N |
M |
SD |
Min |
Max |
Me |
LQ |
UQ |
р |
|
Исследуемый препарат/ |
112 |
0,723 |
0,290 |
0,157 |
1,000 |
0,669 |
0,471 |
1,000 |
0,042 |
|
Препарат сравнения/Comparison Drug |
112 |
0,636 |
0,294 |
0,143 |
1,000 |
0,602 |
0,412 |
1,000 |
|
Примечания: р — p-значение в тесте Манна-Уитни; N — количество субъектов в группе; M — среднее арифметическое значение; SD — стандартное отклонение; Min — минимальное значение; Max — максимальное значение; Me — медиана; LQ — нижний квартиль; UQ — верхний квартиль.
Notes: p — p-value in Mann-Whitney test; N — number of subjects in the group; M — arithmetic mean; SD — standard deviation; Min — minimum value; Max — maximum value; Me — median; LQ — lower quartile; UQ — upper quartile.
Полученные результаты углублённого анализа НЯ свидетельствует об отсутствии необходимости дополнительных экспертных оценок безопасности вакцины против ВГА или повторного проведения клинического исследования, что совпадает с результатами базового клинического исследования.
- Оценка информативности и дискриминационной значимости клинико-лабораторных показателей для прогноза развития неблагоприятных реакций
Принимая во внимание, что риск развития нежелательных реакций существенно зависит от специфических особенностей субъекта исследования [13], а принципиальной особенностью разработанного метода является получение индивидуализированного количественного показателя на основе интеграции качественных параметров НЯ, представилась возможности установления лиц с повышенной индивидуальной чувствительностью к введению вакцины (осуществление прогноза развития неблагоприятных реакций). В качестве критериев для отнесения добровольца к категории повышенной индивидуальной чувствительности являлись характеристика уровня индивидуальной интегральной оценки — к ней отнесены лица с ВРН НЯ (0,37 > Di ≥ 0,20) и ВВРН НЯ (Di < 0,20) по шкале Харрингтона (группа повышенной индивидуальной чувствительности (ГПИЧ)). В другую группу (группа умеренной индивидуальной чувствительности (ГУИЧ)) вошли добровольцы с НВРН НЯ (1,00 ≥ Di ≥ 0,37), включая лиц, у которых НЯ не установлены. В качестве зависимых переменных (прогностических признаков) выступали результаты обследования добровольцев на этапе скрининга. Оценивали информативность отдельных показателей и эффективность классификации — способность дискриминировать (различать) группы с использованием комплекса показателей.
Для оценки информативности отдельных гендерно-возрастных и клинико-лабораторных показателей использовали ОМДА. В качестве критериев для оценки информативности переменных применяли статистику ЧЛУ, значение F-критерия и уровень статистической значимости показателя. Статистически значимым принимали уровень меньше или равно 0,05.
Показателем информативности совокупности дискриминантных переменных и эффективности применения дискриминантной функции для интерпретации межгрупповых различий явился процент правильно распознанных объектов. Доля правильно распознанных объектов свидетельствует о степени соответствия дискриминантной модели эмпирическим данным.
Для оценки возможности выделения лиц с различным уровнем индивидуальной чувствительности к вакцинации использовали данные количественного интегрального анализа НЯ по системам у каждого добровольца, включая лиц с отсутствием НЯ, а также соответствующие гендерно-возрастные и клинико-лабораторные данные, полученные на этапе скрининга (37 показателей).
В таблице 11 представлены клинико-лабораторные показатели добровольцев на этапе скрининга, дискриминирующие группы ГПИЧ и ГУИЧ в порядке убывания их эффективности (в порядке уменьшения F-статистики) с присвоением соответствующих ранговых мест (приведены только те показатели, у которых значение F-статистики было больше 1).
|
Таблица 11. Характеристика клинико-лабораторных показателей субъектов на этапе скрининга, дискриминирующих группы ГПИЧ и ГУИЧ Table 11. Characterization of clinical and laboratory parameters of subjects at the screening stage who discriminate against the PEACH and GUICH groups |
||||
|
Показатель/Indicator |
Результаты дискриминантного анализа/ |
Ранговое место/Rank |
||
|
частная лямбда Уилкса/Wilkes's partial lambda |
F-статистика/F-statistic |
p |
||
|
Вес/Weight |
0,944 |
18,414 |
<0,0001* |
1 |
|
ИМТ/BMI |
0,951 |
15,966 |
<0,0001* |
2 |
|
Рост/Height |
0,953 |
15,414 |
0,0001* |
3 |
|
Общий белок/Total protein |
0,957 |
14,015 |
0,0002* |
4 |
|
ДАД/DBP |
0,959 |
13,150 |
0,0003* |
5 |
|
ГГТП/GGTP |
0,965 |
11,231 |
0,001* |
6 |
|
САД/SBP |
0,974 |
8,397 |
0,004* |
7 |
|
Глюкоза/Glucose |
0,980 |
6,430 |
0,012* |
8 |
|
Интервал PQ/PQ interval |
0,992 |
2,664 |
0,104 |
9 |
|
Эритроциты/Erythrocytes |
0,992 |
2,642 |
0,105 |
10 |
|
ЧСС/HR |
0,992 |
2,624 |
0,106 |
11 |
|
Общий билирубин/Total bilirubin |
0,993 |
2,083 |
0,150 |
12 |
|
Гемоглобин/Hemoglobin |
0,994 |
1,740 |
0,188 |
13 |
|
Возраст/Age |
0,995 |
1,609 |
0,206 |
14 |
|
Удельный вес мочи/Specific gravity of urine |
0,996 |
1,248 |
0,265 |
15 |
|
ЧДД/RR |
0,996 |
1,232 |
0,268 |
16 |
|
ТТ/BT |
0,996 |
1,211 |
0,272 |
17 |
|
Комплекс QRS/QRS complex |
0,996 |
1,191 |
0,276 |
18 |
|
Тромбоциты/Platelets |
0,996 |
1,102 |
0,295 |
19 |
Примечания: * — F-статистика статистически значима (р ≤0,05); ГПИЧ — группа повышенной индивидуальной чувствительности; ГУИЧ — группа умеренной индивидуальной чувствительности; ИМТ — индекс массы тела; ДАД — диастолическое артериальное давление; ГГТП — гамма-глутамилтранспептидаза; САД — систолическое артериальное давление; ЧСС — частота сердечных сокращений; ЧДД — частота дыхательных движений; ТТ — температура тела.
Notes: * — F-statistic is statistically significant (p ≤0,05); GIIS — the group of increased individual sensitivity; GMIS — group of moderate individual sensitivity; BMI — body mass index; DBP — diastolic blood pressure; GGTP — gamma-glutamyltranspeptidase; SBP — systolic blood pressure; HR — heart rate; RR — respiratory rate; BT — body temperature.
Анализ данных таблицы 11 показал, что только 8 из 37 показателей вносили статистически значимый вклад в дискриминацию групп ГПИЧ и ГУИЧ. Большинство переменных, включая пол добровольцев, существенно не различались между анализируемыми группами. Необходимо отметить, что даже показатели со статистически значимыми уровнями F-статистики по значениям ЧЛУ были близки к 1, что свидетельствует об их низкой информативности. Полученные результаты показали, что несмотря на статистически значимый вклад, который, вероятно, связан со значительным объёмом анализируемых выборок, «клиническая значимость» (важность для разделения групп) отдельных показателей не высока.
С использованием совокупности клинических показателей были рассчитаны функции классификации и построены матрицы классификации выборок (таблица 12).
|
Таблица 12. Наблюдаемое и предсказанное распределение по исследуемым группам с использованием клинико-лабораторных показателей на этапе скрининга добровольцев (матрица классификации) Table 12. Observed and predicted distribution by study groups using gender-age and anthropometric indicators |
||||
|
Характеристика матрицы классификации/Characteristics of the classification matrix |
||||
|
Наблюдаемое распределение/ |
Предсказанное распределение/Predicted distribution |
Доля правильной классификации, %/Proportion of correct classification, % |
||
|
Группа добровольцев/Group of volunteers |
Количество субъектов в группе/Number of subjects per group |
Группа добровольцев/ |
||
|
ГУИЧ/GMIS |
ГПИЧ/GIIS |
|||
|
ГУИЧ/GMIS |
228 |
198 |
30 |
86,8 |
|
ГПИЧ/GIIS |
119 |
44 |
75 |
63,0 |
|
Всего/Total |
78,7 |
|||
Анализ данных, представленных в таблице 12, показал, что использование клинико-лабораторных переменных позволяет достичь достаточно высокого общего уровня дискриминации — около 79 %, однако в группе ГПИЧ доля правильной классификации составила всего 63 %. Относительно невысокий уровень правильной классификации в группе лиц, обладающих возможной повышенной чувствительностью к вакцинам для профилактики вирусного гепатита А, на наш взгляд, связан с использованием неспецифических показателей, полученных на этапе скринирования добровольцев. Принимая во внимание, что НЯ установлены по 10 системам организма, очевидна необходимость разработки алгоритмов с использование специфических показателей, позволяющих выявлять лиц с высокой индивидуальной чувствительностью по отдельным системно-органным комплексам.
Также необходимо учитывать, что полученные значения правильной классификации получены на т. н. «обучающей» выборке. При использовании «экзаменующей» выборки итоговые значения эффективности классификации с высокой вероятностью были бы значительно меньше, однако принципиальная возможность прогнозирования развития неблагоприятных отклонений в состоянии организма при вакцинации, на наш взгляд, показана.
Примечания: ГУИЧ — группа умеренной индивидуальной чувствительности; ГПИЧ — группа повышенной индивидуальной чувствительности.
Notes: GMIS — group of moderate individual sensitivity; GIIS — group of increased individual sensitivity.
Заключение / Conclusion
В ходе выполнения настоящей работы на примере вакцин для активной профилактики вирусного гепатита А апробированы все этапы количественного интегрального анализа на системно-органном и организменном уровнях. Полученные данные свидетельствовали об отсутствии необходимости дополнительной экспертной оценки или повторного проведения клинического исследования.
Из 576 НЯ, установленных в ходе клинических исследований, выделены 253 НЯ с наиболее неблагоприятными характеристиками (по одному НЯ на каждую систему организма), включая добровольцев с «высокой вероятностью развития НЯ» (8,0 % в группе ИП и 23,2 % в группе ПС) и «возможным развитием НЯ» (35,7 % в группе ИП и 39,3 % в группе ПС), которых можно отнести к категории лиц с повышенной индивидуальной чувствительностью после введения вакцин для профилактики вирусного гепатита А.
На системно-органном уровне НЯ у лиц с повышенной индивидуальной чувствительностью были связаны с общими нарушениями и реакциями в месте введения, нарушениями со стороны нервной системы, нарушениями со стороны мышечной, скелетной и соединительной ткани, с инфекциями и инвазиями, с желудочно-кишечными нарушениями, нарушениями со стороны дыхательной системы и с лабораторными и инструментальными данными.
В целом установленные НЯ соответствовали перечню нежелательных реакций, представленных в протоколе исследования, однако приведенная в протоколе частота встречаемости большинства из них (за исключением общих нарушений и реакций в месте введения) — нечасто (> 1/1 000 и < 1/100), редко (> 1/10 000 и < 1/1 000), была ниже аналогичного показателя в настоящем исследовании, что, возможно, потребует уточнения характеристики «частота встречаемости нежелательных реакций» для вакцины против ВГА.
С использованием дискриминантного анализа проведена оценка информативности отдельных гендерно-возрастных и клинико-лабораторных показателей, полученных во время скрининга добровольцев, для разделения групп лиц с повышенной и умеренной индивидуальной чувствительностью к введению вакцин для профилактики вирусного гепатита А. Установлено, что только 8 из 37 показателей, к которым относились антропометрические характеристики, жизненно-важные показатели, данные биохимического анализа крови, вносили статистически значимый вклад в разделение анализируемых групп. Однако необходимо отметить низкую информативность представленных показателей, оцененную с использованием частной лямбды Уилкса, что свидетельствует о недостаточной специфичности признаков среди данных скринингового обследования для прогноза развития неблагоприятных отклонений в состоянии здоровья.
Общий уровень дискриминации анализируемых групп на основе данных скринингового обследования добровольцев, оцененный с использованием функции классификации, составил около 79 %. Доля правильной классификации группы лиц с повышенной индивидуальной чувствительностью к введению препарата составила 63 %, что, на наш взгляд, является достаточно приемлемым уровнем с учётом используемого набора прогностических признаков.
Проведённая апробация индивидуализированного интегрального анализа нежелательных явлений при клинических испытаниях вакцин показала перспективность его применения для выделения лиц с повышенной индивидуальной чувствительностью в ходе вакцинопрофилактики на основе исходных гендерно-возрастных, демографических и клинико-лабораторных показателей.
Выбор показателей для прогноза развития неблагоприятных отклонений в состоянии здоровья при использовании вакцин для активной профилактики вирусного гепатита А должен основываться на специфических маркерах поражения органов и систем, ранее описанных для представленной группы препаратов, с учётом частоты встречаемости нежелательных реакций, включая данные автоматизированной информационной системы «Фармаконадзор».
Для повышения эффективности прогнозирования целесообразно объединение исходных данных о нежелательных реакциях при применении вакцин со сходными органоспецифическими и системными нарушениями как в ходе клинических исследований, так и по данным автоматизированной информационной системы «Фармаконадзор», а также расширение методов математико-статистической обработки данных, включая нейросетевой анализ.
Список литературы
1. Верведа АБ, Василюк ВБ, Сыраева ГИ, Фарапонова МВ. Оптимизация подходов к анализу нежелательных явлений при проведении клинических исследований биоэквивалентности. Безопасность и риск фармакотерапии. 2024;12(1):24-34.
2. Верведа А.Б., Василюк В.Б., Сыраева Г.И., Фарапонова М.В., Попов А.В. Реализация количественного интегрального анализа при оценке нежелательных явлений при проведении клинических исследований: в фокусе трастузумаб. Качественная клиническая практика. 2024;(4):21-34. Doi: 10.37489/2588-0519-2024-4-21-34. EDN: ZEWDXG
3. Саати Т. Принятие решений. Метод анализа иерархий: Пер. с англ. – М.: Радио и связь, 1993. – 320 с.
4. Общий дискриминантный анализ [интернет]. Интеллектуальный Портал Знаний. [доступ 05.03.20255]. Доступ по ссылке: http://statistica.ru/textbook/obshchiy-diskriminantnyy-analiz/
5. Решение Совета Евразийской Экономической Комиссии от 3 ноября 2016 года № 79 «Об утверждении Правил надлежащей клинической практики Евразийского экономического союза»
6. Национальный стандарт Российской Федерации ГОСТ Р 52379-2005 «Надлежащая клиническая практика»
7. Рекомендациями Коллегии Евразийской экономической комиссии от 17.07.2018 № 11 «О Руководстве по общим вопросам клинических исследований»
8. Заде Л.А. Роль мягких вычислений и нечеткой логики в понимании, конструировании и развитии информационных/интеллектуальных систем. Новости искусственного интеллекта. 2001;(2–3):7–11.
9. Полещук ОМ. Построение интегральных моделей в рамках нечеткой экспертной информации. Лесной вестник. 2003;(5):155–9.
10. Каган ЕС. Построение комплексных нечетких оценок эффективности деятельности вуза и публичной формализации деятельности преподавателя. Известия Алтайского государственного университета. 2015;(1–1):152–7.
11. Адлер ЮП, Маркова ЕВ, Грановский ЮВ. Планирование эксперимента при поиске оптимальных условий. М.: Наука; 1976.
12. Макарова ИЛ. Анализ методов определения весовых коэффициентов в интегральном показателе общественного здоровья. Символ науки. 2015;(7–1):87–95.
13. Ушкалова ЕА, Зырянов СК, Гопиенко ИА. Воспроизведенные препараты: соотношение польза/риск. Неврология, нейропсихиатрия, психосоматика. 2021;13(6):98-104. https://doi.org/10.14412/2074-2711-2021-6-98-104
Об авторах
А. Б. ВерведаРоссия
Верведа Алексей Борисович — с. н. с.; к. м. н., в. н. с.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Г. И. Сыраева
Россия
Сыраева Гульнара Ислямовна — зам. управляющего по качеству; к. м. н. ассистент кафедры клинической фармакологии и доказательной медицины
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
В. Б. Василюк
Россия
Василюк Василий Богданович — управляющий; д. м. н., профессор кафедры токсикологии, экстремальной и водолазной медицины
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
М. В. Фарапонова
Россия
Фарапонова Мария Валерьевна — зам. управляющего по научной работе
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Рецензия
Для цитирования:
Верведа А.Б., Сыраева Г.И., Василюк В.Б., Фарапонова М.В. Перспективы применения индивидуализированного интегрального анализа нежелательных явлений при клинических исследованиях вакцин. Реальная клиническая практика: данные и доказательства. 2025;5(3):21-37. https://doi.org/10.37489/2782-3784-myrwd-080. EDN: UNSHEV
For citation:
Verveda A.B., Syraeva G.I., Vasilyuk V.B., Faraponova M.V. Prospects for the application of individualized integrated analysis of adverse events in vaccine clinical trials. Real-World Data & Evidence. 2025;5(3):21-37. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-080. EDN: UNSHEV






























