Перейти к:
STaRT-RWE: структурированный шаблон для планирования и отчëтности о проведении исследований в условиях реальной клинической практики
https://doi.org/10.37489/2782-3784-myrwd-19
EDN: GBRMFZ
Аннотация
Цель исследования. Выделить особенности STaRT-RWE (структурированного шаблона для планирования и отчётности о проведении исследований в условиях реальной клинической практики — RWE).
Материалы и методы. Проведён обзор и анализ публикаций, касающихся особенностей получения доказательств в условиях реальной клинической практики, упрощения сбора доказательных данных, особенно при параллельном рассмотрении нескольких исследований RWE.
Результаты. Благодаря использованию данного шаблона происходит отбор критически важных деталей. Важно и то, что при этом разная интерпретация не влияет на результаты и на решение.
Выводы. STaRT-RWE предназначен для уменьшения неправильного толкования и создания чётких ожиданий в отношении того, как генерируется RWE касаемо того, какой дизайн исследования и детали должны сообщаться, как и где эти данные должны проявляться, что, в свою очередь, позволит лицам, принимающим решения в области здравоохранения, эффективно оценивать достоверность исследований RWE.
Ключевые слова
Для цитирования:
Плавинский С.Л., Баринова А.Н. STaRT-RWE: структурированный шаблон для планирования и отчëтности о проведении исследований в условиях реальной клинической практики. Реальная клиническая практика: данные и доказательства. 2022;2(3):20-34. https://doi.org/10.37489/2782-3784-myrwd-19. EDN: GBRMFZ
For citation:
Plavinskij S.L., Barinova A.N. STaRT-RWE: structured template for planning and reporting on the implementation of real-world evidence studies. Real-World Data & Evidence. 2022;2(3):20-34. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-19. EDN: GBRMFZ
Введение
Во всём мире система получения доказательств в условиях реальной клинической практики (англ. Real-World Evidence; RWE) стала предметом широкого интереса в здравоохранении [1]. Именно данная клиническая практика позволяет участникам системы здравоохранения провести глубокий анализ эффективности терапии на основании полученных данных о клинических и экономических исходах в условиях системы здравоохранения. Показатели эффективности медицинских технологий зависят от многих факторов, например от степени внедрения среди клиницистов, и могут изменяться во времени [2]. Примеры использования RWE включают в себя:
- помощь в выявлении неудовлетворённых медицинских потребностей [3];
- дизайн зарегистрированных клинических исследований [4];
- пострегистрационную оценку безопасности лекарственных средств и фармаконадзор [5];
- решения об оплате и страховом покрытии расходов [6];
- улучшение качества здравоохранения [7];
- новые показания к применению медицинских изделий [8];
- оценку технологий здравоохранения [9];
- разработку руководств по клинической практике [10].
Хотелось бы отметить, что термины RWD иRWE (Real-World Data и Real-World Evidence) по‑прежнему не имеют должного уровня согласованности во всём мире: распространённым заблуждением является то, что традиционные рандомизированные контролируемые исследования не отражают ситуацию в реальном мире, а все наблюдательные исследования — отражают [1]. На самом деле рандомизированные контролируемые исследования могут включать компоненты реальных условий, а исследования в условиях реальной клинической практики могут включать элементы, которые не являются частью реального лечения. Данный факт ведёт к пониманию того, что достоверность полученных данных увеличивается в том случае, если в дизайн включается больше данных рутинной клинической практики. В марте 2022 года вступило в силу Решение Совета Европейской экономической комиссии (ЕЭК) от 17.03.2022 №36 «О внесении изменений в Правила регистрации и экспертизы лекарственных средств для медицинского применения», где были даны определения для RWD и RWE [11]. Так, данные реальной клинической практики (RWD) определяют как данные, относящиеся к состоянию здоровья пациента и (или) к процессу оказания медицинской помощи, полученные из различных источников. В свою очередь, доказательства, полученные на основе данных реальной клинической практики (RWE), — клинические доказательства в отношении применения и потенциальной пользы или риска применения лекарственного препарата, полученные на основе сбора и анализа данных реальной клинической практики.
Данные могут быть получены из широкого круга источников: интервенционных исследований (большие упрощённые рандомизированные испытания, прагматические клинические испытания, пострегистрационные исследования безопасности); неинтервенционных исследований (пострегистрационные исследования безопасности, когортные исследования, исследования по типу «случай-контроль»); регистров и компьютерных баз данных на основе регистров; данных о случаях оказания медицинской помощи пациентам, полученных от страховых медицинских организаций и фондов; данных электронных медицинских карт и интегрированных электронных медицинских карт; данных носимых медицинских устройств и интернета медицинских вещей; анкетирования о состоянии здоровья и исходов, сообщаемых пациентами [1].
Проблемы RWE
Ключевым препятствием для исследований RWE является двусмысленность полученных данных и отсутствие подробностей их получения: исследования RWE имеют большую вариабельность в плане дизайна и множества вариантов анализа полученных данных. Из-за того, что разделы, посвящённые методам, в исследовательских публикациях должны содержать достаточно подробностей, чтобы другие лица, имеющие доступ к данным, могли воспроизвести результаты, попыткам воспроизвести результаты исследований баз данных препятствовало отсутствие ясности в отчётах о важных деталях реализации исследования. Многие организации, осознавая эту проблему, создали руководства и контрольные списки для отчётов об исследованиях. Однако эти рекомендации носят слишком общий характер, чтобы охватить широкую базу, что оставляет место для двусмысленности полученных данных, различных предположений и неправильного толкования при планировании и проведении исследований RWE [12]. Всё это приводит к затруднению сбора доказательных данных при параллельном рассмотрении нескольких исследований RWE [1].
Для решения этих проблем Wang S. и соавт. (2021 г.) был разработан структурированный шаблон для планирования и создания отчётов о проведении исследований безопасности и эффективности лечения RWE (англ. Structured template and reporting tool for real world evidence; STaRT-RWE) [13]. Междисциплинарный характер, мультибазовость данных и совместный характер разработки и проведения исследований RWE могут быть улучшены за счёт более чёткого сообщения критически важных деталей. Это особенно актуально для исследований, проводящихся в сотрудничестве между несколькими группами, где различная интерпретация может существенно повлиять на результаты. Недвусмысленное документирование предполагаемых параметров проведения исследования может повысить эффективность коммуникации между исследовательскими группами и лицами, принимающими решения при рассмотрении таких исследований.
Необходимы своевременные высококачественные доказательства для обоснованного принятия решений. Чтобы иметь основу для оценки и разграничения тщательно спланированных исследований от исследований с проблемами валидности, регулирующие органы и другие лица, принимающие решения, призвали исследователей проводить и сообщать об исследованиях RWE с использованием стандартов, согласованных профессиональными сообществами, посвящёнными RWE [14]. Далее будет приведён шаблон Wang S. и соавт. (2021 г.) — STaRT-RWE [13].
Структурированный шаблон для планирования и создания отчётов о проведении исследований RWE (STaRT-RWE)
При разработке шаблона планирования исследований одной из целей является использование контрольных списков: элементы из существующих контрольных списков должны соответствовать основным заголовкам в структурированных таблицах, в которых отображаются важные детали. Таким образом, шаблон должен быть заполнен при разработке исследования, обновлён с учётом изменений версии в период реализации, а затем предоставлен совместно с окончательными результатами исследования, чтобы обеспечить возможность оценки и воспроизведения исследования. При таком использовании шаблон повысит адекватность проведения исследования, а также поможет понять методы и достоверно интерпретировать результаты [13].
Этот многоцелевой инструмент особенно актуален для исследований по оценке гипотез об эффективности и безопасности лечения, которые предназначены для того, чтобы повлиять на итоговое решение, но также совместим с исследованиями RWE различных типов (например, исследовательскими, описательными, прогностическими).
Шаблоны таблиц и рисунков STaRT-RWE
На практике записи шаблонной таблицы будут зависеть от параметров дизайна и анализа, выбранных для исследования. Подробные инструкции, встроенные в текст заголовка таблицы шаблона, можно удалить после заполнения таблицы [13]. Шаблон включает несколько таблиц, которые подробно представлены ниже.
Административная информация
Административная информация обобщается в первых трёх таблицах шаблона, включая оглавление, название исследования, первичные и вторичные цели PICOT (population, intervention, comparator, outcome, and time horizon — популяция, вмешательство, вмешательство в группе сравнения, результат и временной горизонт); другие административные детали, включая информацию о пересмотрах (версиях документа) с указанием не только того, что изменилось, но и того, почему изменения были внесены, когда они были внесены, с отображением истории запланированных анализов. Следует отметить, что таким же образом оформляются по требованиям регуляторных органов протоколы клинических испытаний, которые используются для регистрации и лицензирования лекарственных средств и медицинских изделий.
Схема дизайна исследования
Схема дизайна исследования даёт краткое описание того, как была создана аналитическая когорта (см. рис.). Она читается сверху вниз, показывая последовательность действий, предпринятых для создания когорты. Вертикальная стрелка обозначает день 0 — точку, в которой соблюдается критерий, определяющий включение в исследование. Размер и расположение горизонтальных столбцов визуально показывают временной интервал оценочных окон для критериев включения или невключения, ковариат и наблюдений по отношению к 0‑му дню, в то время как для обозначения временного интервала в каждом столбце используют стандартные математические диапазоны. На диаграмме также могут быть примечания, содержащие подробные сведения о том, что определено в каждом из окон оценки [13].

Рис. Пример схемы дизайна исследования (адаптировано по [13])


Таблица параметров изучаемой популяции
Таблица параметров изучаемой популяции (таблица 3) содержит больше деталей, чем схема дизайна исследования: метаданные об источнике данных, любые связи данных, а также имя или версию программного обеспечения, используемого для создания аналитической когорты.
В подразделе A таблицы 3 приложения указываются название и версия источника данных, а также любые применяемые критерии выборки (например, включение пациентов только с определённым диагнозом). Если была задействована связь данных, в таблице есть место для цитаты или ссылки на приложение с описанием связи (например, алгоритм создания, характеристики эффективности формирования связей).
Алгоритмы для данных о входе в когорту представлены в разделе 3А, критерии включения в разделе 3B, ковариаты в разделах 3C и 3D, исходы в разделе 3E (* в алгоритмах означает использование маски (англ. wildcard), т. е. символа, используемого для представления любой одиночной буквенно-цифровой цифры в кодовых алгоритмах, например 410.*1, где * — маска).
Все временные окна привязаны ко дню включения в исследование (день 0), если не указано иначе. () означает открытые интервалы, которые не включают конечные точки, [] означает закрытые интервалы, которые включают конечные точки.
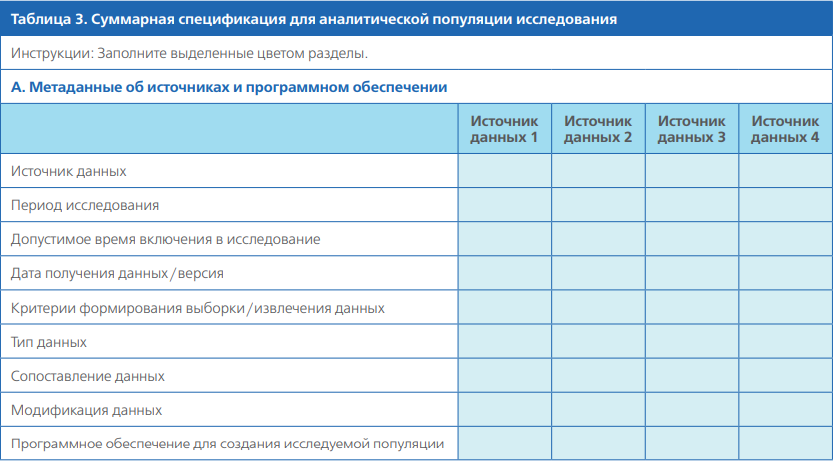

Прочие разделы шаблона таблицы параметров изучаемой популяции
В остальных подразделах этой таблицы в структурированном виде приведены рабочие определения дат включения в когорту и воздействия, критериев включения / невключения, а также порядок применения исследуемого лекарственного средства, ковариаты, исходы и время наблюдения (таблицы 3В — H). Эти подразделы обобщают: то, что измеряется; время измерения; условия оказания помощи (стационарное, амбулаторное, отделение неотложной помощи); типы кодов, используемые для определения меры (код препарата, диагноза, процедуры или лаборатории); источники применяемых алгоритмов (публикации или клинические обзоры).
Для алгоритмов, основанных на диагностических кодах, шаблон также включает раздел, позволяющий исследователям определить, должны ли коды находиться в основной позиции (указание, что диагноз является основной причиной события). Фактические клинические коды, используемые для определения, для удобства указаны в приложениях к шаблонным таблицам. Приложения к шаблонным таблицам структурированы, что позволяет им легко поддаваться автоматическому компьютерному анализу.
Первый подраздел (таблица 3B) посвящён подробному описанию дня 0, определяющего критерии включения в исследуемую популяцию. Он включает поля для указания того, сколько раз пациенты могут входить в когорту, типа записи, периода «отмывки» для записи даты включения. Если это уместно, то в разделе дополнительно можно задать опции ввода нового события (например, новые пользователи лекарственного средства или впервые диагностированные пациенты с определённым заболеванием).
В подразделах о критериях включения и невключения (таблицы 3C‑D) есть раскрывающиеся поля для указания того, применяются ли критерии до или после выбора даты включения в популяцию аналитического исследования.


Для ковариат (таблица 3E) также определяется способ операционализации переменной (например, непрерывная, бинарная, категориальная) с возможностью предоставления более подробной информации о преобразованиях.

Шаблон также включает необязательный раздел, посвящённый эмпирически определённым ковариатам (таблица 3F), где предоставляется исходный код или ссылка на алгоритм, используемый для выбора ковариат на основе данных.

Кроме того, по всей таблице поля показывают, был ли параметр исследования задан заранее и изменялся ли он при анализе чувствительности.
В подразделе результатов (таблица 3G) указывается первичный результат вместе с характеристиками измерения. Эффективность измерения результатов может основываться на опубликованных документах по проверке алгоритмов, на прямой проверке результатов в рамках аналитической когорты, или исследователи могут прямо отметить отсутствие информации о точности установления результатов. В этом разделе также указаны тип исхода и соответствующие окна «отмывки» для определения заболеваемости, если это уместно, условия оказания помощи и диагностические позиции.
В подразделе последующего наблюдения (таблица 3H) исследователи определяют, когда начинается наблюдение (по отношению к включению когорты) и когда оно заканчивается. В дальнейшем это может помочь исследователям рассмотреть каждый вариант и сделать активный выбор. Это также разъясняет рецензенту, что из указанного применимо в качестве критериев прекращения (окончание) наблюдения. Если выбрано цензурирование при прекращении, таблица включает разделы для определения продолжительности воздействия, включая «льготный» период для учёта режима приёма лекарственного средства (чтобы определить, попадает ли выявленный эффект в предполагаемое окно воздействия).


Дополнительные таблицы
Спецификации анализа представлены в отдельной таблице (таблица 4) и включают поля для проверяемой гипотезы и изучаемой совокупности для первичного анализа, а также соответствующие подгруппы, используемые для вторичного анализа в последующих разделах. Здесь можно сообщить о пакетах программного обеспечения, подходящих моделях, типе смешанной корректировки и включённых переменных, с указанием некоторых параметров, таких как коэффициент соответствия, формулы для измерений, правила усечения. Эта таблица также включает поля для указания того, как обрабатываются отсутствующие данные в анализе основной группы и подгрупп (например, невключение пациентов с отсутствующим или неизвестным полом).

Также существует отдельная таблица для анализа чувствительности (таблица 5), в которой исследователи могут указать, какие параметры изменяются, объяснить причину изменений и подробно описать, что исследователи ожидают узнать из этого анализа чувствительности по сравнению с первичным анализом.

Существуют дополнительные оболочки таблиц исследуемой популяции, в которых (таблицы 6 и 7) представлены результаты с учётом «отсева» — они отражают изменяющуюся информацию по мере применения критериев включения и невключения к исходным данным. Также имеется таблица расчёта мощности и размера выборки для подсчётов осуществимости исследования, если данная информация актуальна. Точное содержание этой таблицы может варьироваться в зависимости от типа расчёта.


Помимо прочего, существует глоссарий используемых терминов, помогающий избежать их неправильного толкования (таблица 8).


Таблицы-шаблоны всегда должны сопровождаться приложениями, содержащими конкретные списки клинических кодов (например, Международная классификация болезней — клиническая модификация, 10‑я редакция), используемые для определения критериев включения в исследование или воздействия, включения или невключения, вмешивающихся факторов. Результаты должны быть структурированы, для простоты чтения, записи и обработки информации с помощью автоматизированных компьютерных алгоритмов.
Эти таблицы также могут сопровождаться, при необходимости, дополнительными приложениями, в которых подробно описаны решения, принятые в процессе преобразования исходных данных в общую модель, и предоставляют дополнительную информацию о связях данных или других этапах обработки данных, а также о приложениях, которые предоставляют ссылки на код, используемый для создания и анализа исследуемой совокупности.
Чего удалось достичь благодаря STaRT-RWE
- Данный шаблон предоставляет структурированный способ сообщить о сложном дизайне исследования и вариантах анализа.
- Сообщает базовую информацию о методологии исследования, тем самым улучшает понимание в отношении решений, касаемых проведения исследования.
- Используя табличный и визуальный форматы, сводит к минимуму вероятность неправильного толкования данных.
- Устанавливает чёткие требования к обмену информацией о методах RWE.
- Помогает исследовательским группам быть всесторонними и последовательными при планировании и сообщении важных деталей предполагаемых научных решений.
- Облегчает интерпретацию результатов исследования (рецензенты получают информацию о том, как были получены результаты и какие стратегии были использованы для того, чтобы избежать потенциальных ошибок).
- Шаблон служит направляющим инструментом для разработки и проведения воспроизводимых исследований RWE.
- Шаблон предназначен для помощи в разработке, проведении и обзоре исследования таким образом, чтобы повысить ценность исследования для исследователей, спонсоров и рецензентов.
Обсуждение ограничений шаблона STaRT-RWE [13]
Шаблон STaRT-RWE имеет несколько ограничений.
Во-первых, несмотря на гибкость шаблона, структура таблиц может оказаться неудобной для некоторых типов исследования.
Во-вторых, использование шаблона в отношении обеспечения ясности научных решений не гарантирует, что эти решения приведут к беспристрастным выводам. Тем не менее правильная интерпретация результатов исследования будет значительно легче, если рецензенты увидят недвусмысленную информацию о том, как были получены эти результаты и какие стратегии были использованы для устранения потенциальных ошибок.
В-третьих, шаблон фокусируется в первую очередь на решениях по реализации исследования.
Некоторые заинтересованные стороны упомянули о создании различными организациями разрозненных и нескоординированных сайтов для регистрации и хранения протоколов. Тем самым отсутствие централизованного сайта или процесса, предназначенного для размещения протоколов RWE, было расценено как проблема.
Другие выразили озабоченность по поводу того, что шаблон слишком сфокусирован на когортный дизайн или слишком ориентирован на США. Было принято решение разработать библиотеку примеров STaRT-RWE, содержащую общие варианты использования, включающие различные планы исследований, источники данных и более сложные алгоритмы, чтобы определить ключевые параметры исследования для демонстрации удобства использования.
Вывод
STaRT-RWE предназначен для уменьшения неправильного толкования и создания чётких ожиданий в отношении информирования о том, как генерируется RWE, — ожиданий относительно того, какой дизайн исследования и детали анализа следует сообщать, а также как и где эта информация должна появляться. Наличие базового уровня информации о методологии исследования даёт больше ясности в отношении решений о проведении исследования. Эта информация повысит способность лиц, принимающих решения в области здравоохранения, эффективно оценивать достоверность исследования RWE.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы декларируют отсутствие конфликта интересов. Участие авторов. Плавинский С.Л., Баринова А. Н. — написание текста, редактирование, финальное утверждение рукописи. Финансирование: статья подготовлена без финансовой поддержки.
ADDITIONAL INFORMATION
Conflict of interests. The authors declare no conflict of interest.
Participation of authors. Plavinskij SL, Barinova AN — text writing; editing; final approval of the manuscript.
Funding: The article was prepared without financial support.
Список литературы
1. Колбин А. С. и соавт. Исследования реальной клинической практики. — М. : Издательство ОКИ : Буки Веди, 2020.— 208 с. : ил. — ISBN 978-5-4465-2902-5. — https://izdat-oki.ru/issledovaniya-realnoj-klinicheskoj-praktiki.
2. Sun X, Tan J, Tang L, Guo JJ, Li X. Real world evidence: experience and lessons from China. BMJ 2018;360:j5262. doi: 10.1136/bmj.j5262
3. Charter R, Yeung A, Smith M, et al. The assessment of value for medical devices: using real world evidence (RWE) to quantify unmet needs in diabetes management. Value Health 2016;19:A703. doi: 10.1016/j.jval.2016.09.2046
4. Li G, Sajobi TT, Menon BK, et al. 2016 Symposium on Registry-Based Randomized Controlled Trials in Calgary Registry-based randomized controlled trials—what are the advantages, challenges, and areas for future research? J Clin Epidemiol 2016;80:16–24. doi: 10.1016/j.jclinepi.2016.08.003
5. US Food and Drug Administration. FDA’s Sentinel Initiative. 2016.
6. Garrison LP, Jr, Neumann PJ, Erickson P, Marshall D, Mullins CD. Using real-world data for coverage and payment decisions: the ISPOR Real-World Data Task Force report. Value Health 2007;10:326–35. doi: 10.1111/j.1524-4733.2007.00186.x
7. Ko CY, Hall BL, Hart AJ, Cohen ME, Hoyt DB. The American College of Surgeons National Surgical Quality Improvement Program: achieving better and safer surgery. Jt Comm J Qual Patient Saf 2015;41:199–204. doi: 10.1016/S1553-7250(15)41026-8
8. US Food and Drug Administration. Use of real-world evidence to support regulatory decision-making for medical devices: guidance for industry and food and drug administration staff. 31 August, 2017.
9. Makady A, Ham RT, de Boer A, Hillege H, Klungel O, Goettsch W, GetReal Workpackage 1 Policies for use of real-world data in health technology assessment (HTA): a comparative study of six HTA agencies. Value Health 2017;20:520–32. doi: 10.1016/j.jval.2016.12.003
10. Oyinlola JO, Campbell J, Kousoulis AA. Is real world evidence influencing practice? A systematic review of CPRD research in NICE guidances. BMC Health Serv Res 2016;16:299. doi: 10.1186/s12913-016-1562-8
11. Решение Совета Евразийской экономической комиссии от 17 марта 2022 г. № 36 «О внесении изменений в Правила регистрации и экспертизы лекарственных средств для медицинского применения».
12. Wang SV, Verpillat P, Rassen JA, Patrick A, Garry EM, Bartels DB. Transparency and reproducibility of observational cohort studies using large healthcare databases. Clin Pharmacol Ther 2016;99:325–32. doi: 10.1002/cpt.329
13. Wang SV, Pinheiro S, Hua W, et al. STaRT-RWE: structured template for planning and reporting on the implementation of real world evidence studies. BMJ. Jan 12 2021;372:m4856. doi: 10.1136/bmj.m4856 464
14. International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use. ICH reflection paper: strategic approach to international harmonization of technical scientific requirements for pharmacoepidemiological studies submitted to regulatory agencies to advance more effective utilization of real-world data 2019.
Об авторах
С. Л. ПлавинскийРоссия
Плавинский Святослав Леонидович — д. м. н., профессор кафедры педагогики, философии и права
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов.
А. Н. Баринова
Россия
Баринова Анна Николаевна — д. м. н., профессор кафедры общественного здоровья и управления здравоохранением
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов.
Рецензия
Для цитирования:
Плавинский С.Л., Баринова А.Н. STaRT-RWE: структурированный шаблон для планирования и отчëтности о проведении исследований в условиях реальной клинической практики. Реальная клиническая практика: данные и доказательства. 2022;2(3):20-34. https://doi.org/10.37489/2782-3784-myrwd-19. EDN: GBRMFZ
For citation:
Plavinskij S.L., Barinova A.N. STaRT-RWE: structured template for planning and reporting on the implementation of real-world evidence studies. Real-World Data & Evidence. 2022;2(3):20-34. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-19. EDN: GBRMFZ
JATS XML






























