Том 2, № 3 (2022)
Скачать выпуск
PDF
29 сентября 2022 года Ассоциацией специалистов в области оценки технологии здравоохранения, Ассоциацией клинических фармакологов, Санкт-Петербургским подразделением международного общества фармако-экономических исследований и научного анализа (ISPOR) была организована и проведена III ежегодная научно-практическая конференция с международным участием «Реальная клиническая практика в меняющемся мире. Вызовы и решения». Тема конференции объединила ведущих российских и мировых специалистов в области RWD/ RWE.
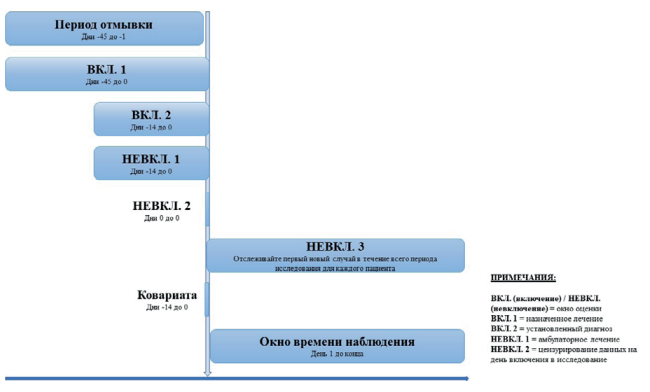
Цель исследования. Выделить особенности STaRT-RWE (структурированного шаблона для планирования и отчётности о проведении исследований в условиях реальной клинической практики — RWE).
Материалы и методы. Проведён обзор и анализ публикаций, касающихся особенностей получения доказательств в условиях реальной клинической практики, упрощения сбора доказательных данных, особенно при параллельном рассмотрении нескольких исследований RWE.
Результаты. Благодаря использованию данного шаблона происходит отбор критически важных деталей. Важно и то, что при этом разная интерпретация не влияет на результаты и на решение.
Выводы. STaRT-RWE предназначен для уменьшения неправильного толкования и создания чётких ожиданий в отношении того, как генерируется RWE касаемо того, какой дизайн исследования и детали должны сообщаться, как и где эти данные должны проявляться, что, в свою очередь, позволит лицам, принимающим решения в области здравоохранения, эффективно оценивать достоверность исследований RWE.
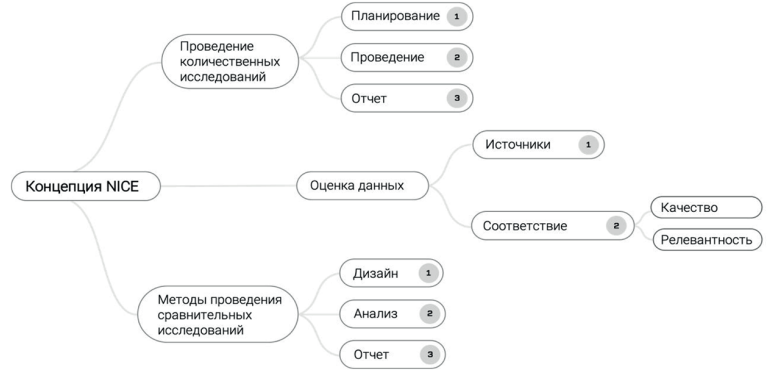
Регулирование проведения исследований реальной клинической практики, которые представляются регуляторам разных стран, для обоснования принятия регуляторных решений в отношении лекарственных препаратов в последние годы приобретает особенную актуальность. Во втором полугодии 2021 года FDA выпустило проекты 3 документов, регулирующих особенности проведения исследований реальной клинической практики. В статье приводятся основные положения и подходы, изложенные в документах FDA. Рассмотренные документы представляют собой международный опыт, которые может быть использован в разработке локальных рекомендаций.
В статье представлен обзор подходов к использованию данных реальной клинической практики (РКП) в области регистрации и оценки технологий здравоохранения в Канаде и Великобритании, а также краткое описание инструментов для принятия управленческих решений в области здравоохранения — Канадского сотрудничества по использованию доказательств, полученных на основе данных реальной клинической практики в области онкологии, электронных баз данных и регистров. Представлена информация о том, в каких случаях возможно и рекомендовано представление данных РКП и какие требования к данным РКП и доказательствам на их основе предъявляют регуляторные агентства.
Адрес издательства:
115522, Москва, Москворечье ул., 4-5-129, ООО «Издательство ОКИ»
Генеральный директор Афанасьева Елена Владимировна
Тел. + 7 (916) 986-04-65; Email: eva88@list.ru
Обработка персональных данныхДля оптимальной работы сайта журнала и оптимизации его дизайна мы используем куки-файлы, а также сервис для сбора и статистического анализа данных о посещении Вами страниц сайта. Продолжая использовать сайт, Вы соглашаетесь на использование куки-файлов и указанного сервиса. PDF-файл является электронной версией специализированного издания, предназначенного для медицинских и фармацевтических работников. Просматривая PDF-файл, пользователь подтверждает, что является медицинским или фармацевтическим работником.