Перейти к:
Пиперациллин-тазобактам: перспективы использования в реальной клинической практике
https://doi.org/10.37489/2782-3784-myrwd-36
EDN: CUYJRQ
Аннотация
Выполнен обзор литературы, касающийся оценки эффективности и безопасности применения комбинированного антисинегнойного защищённого уреидопенициллина пиперациллина/тазобактама. Проведённые рандомизированные клинические исследования и их метаанализ продемонстрировали, что пиперациллин/тазобактам среди некарбапенемных β-лактамов является равноэффективной альтернативой карбапенемам при лечении тяжёлых инфекций, в том числе вызванных штаммами-продуцентами β-лактамаз расширенного спектра действия, вне зависимости от локуса инфекции. Также пиперациллин/тазобактам может быть применён в случаях необходимости проведения деэскалации при терапии карбапенемами. Применение указанной стратегии антимикробной терапии оправдано не только с клинической, но и экономической точки зрения.
Ключевые слова
Для цитирования:
Гомон Ю.М. Пиперациллин-тазобактам: перспективы использования в реальной клинической практике. Реальная клиническая практика: данные и доказательства. 2023;3(3):1-7. https://doi.org/10.37489/2782-3784-myrwd-36. EDN: CUYJRQ
For citation:
Gomon Yu.M. Piperacillin-tazobactam: prospects for use in real-world practice. Real-World Data & Evidence. 2023;3(3):1-7. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-36. EDN: CUYJRQ
Актуальность
В последние десятилетия наблюдается резкий рост распространённости устойчивых к противомикробным препаратам штаммов клинически значимых грамотрицательных бактерий [1–3]. Ограниченность эффективных режимов антимикробной терапии, а также несвоевременность их назначения при лечении тяжёлых инфекций привела к повышению показателей смертности и росту ассоциированных с оказанием медицинской помощи расходов системы здравоохранения [4–6].
β-лактамы, обладая широким спектром действия и благоприятным профилем безопасности, остаются одной из наиболее часто назначаемых групп антимикробных препаратов во всём мире как амбулаторно, так и на стационарном этапе оказания медицинской помощи [7–9]. Ранее проведённое фармакоэпидемиологическое исследование, посвящённое динамике потребления антимикробных препаратов в РФ, продемонстрировало, что потребление карбапенемов, как β-лактамов, эффективных в отношении продуцентов β-лактамаз расширенного спектра действия (БЛРС) в стационарах в период с 2008 по 2022 гг. выросло более, чем в 3,5 раза: с 637 тыс. в 2010 г. до 2 366 тыс. DDDs1 в 2022 г., что подчёркивает актуальность полирезистентных инфекций для системы здравоохранения РФ [9].
Учитывая крайне ограниченное число некарбапенемных β-лактамов, которые можно было бы использовать в качестве альтернативы карбапенемам в лечении тяжёлых инфекций, вызванных БЛРС-продуцентами, более широкое применение защищённых уреидопенициллинов, в том числе с использованием модифицированных стратегий дозирования могло бы стать потенциально клинически и экономически оправдано [10].
Общая характеристика пиперациллина/ тазобактама
Пиперациллин/тазобактам — это комбинированный препарат антисинегнойного уреидопенициллина пиперациллина и ингибитора β-лактамазы тазобактама. При одновременном применении с пиперациллином тазобактам восстанавливает и расширяет антибактериальное действие пиперациллина и, таким образом, усиливает его клинический потенциал [11–14].
Тазобактам проявляет хорошую ингибирующую активность в отношении β-лактамаз класса А, включая пенициллиназы, цефалоспориназы и БЛРС. Однако он обладает меньшим ингибирующим действием в отношении подтипов карбапенемаз класса А и β-лактамаз класса D. Не активен в отношении цефалоспориназ класса С и металлобеталактамаз класса В.
Таким образом, благодаря широкому спектру антибактериальной активности, обеспечиваемой пиперациллином/тазобактамом, он эффективен в лечении полимикробных инфекций, вызванных аэробными или анаэробными бактериями, в том числе продуцирующими β-лактамазы.
Пиперациллин/тазобактам обладает хорошей активностью in vitro в отношении чувствительных к метициллину S. aureus, коагулазонегативных стафилококков, Streptococcus pyogenes, чувствительных к пенициллину штаммов S. pneumoniae и Enterococcus faecalis.
Пиперациллин/тазобактам обладает высокой активностью в отношении анаэробов, включая Bacteroides spp., особенно B. fragilis. Он также обладает высокой активностью в отношении Clostridium spp.
Многие энтеробактерии, включая Escherichia coli, Klebsiella spp. и Enterobacter spp., чувствительны к пиперациллин/тазобактаму. В тоже время, согласно данным онлайн-платформы анализа данных резистентности к антимикробным препаратам в России (AMRmap), у нозокомиальных штаммов энтеробактерий в 2018–2019 гг. в 31,8 % случаев была выявлена продукция карбапенемаз (среди K. pneumoniae — 55,6 %, среди E. coli — 0,04 %). Из них большинство (62,9 %) относились к молекулярному классу D группы OXA48; ещё 27,3 % относились к классу B группы NDM-1 [15][16]
Пиперациллин/тазобактам обладает антисинегнойной активностью. Необходимо отметить, что устойчивость нозокомиальных штаммов P. aeruginosa к пиперациллину/тазобактаму в РФ в настоящее время достигает 61,1 % [15][16]. В 42,4 % случаев синегнойной инфекции выявлены гены приобретённых карбапенемаз: металло-β-лактамазы (МБЛ) групп VIM и IMP — в 83,2 и 0,8 %, соответственно; сериновые карбапенемазы группы GES-5–15,2 % случаев. Продуценты МБЛ проявляли высокую устойчивость ко всем антибиотикам, кроме азтреонама и полимиксинов; продуценты GES-5 — к большинству препаратов, кроме цефтазидима/авибактама и полимиксинов.
Штаммы Stenotrophomonas maltophilia, метициллинрезистентные штаммы S. aureus (MRSA) и многие метициллинрезистентные коагулазонегативные стафилококки устойчивы к пиперациллину/тазобактаму.
Показания к применению
И пиперациллин, и тазобактам хорошо распределяются в различных тканях и жидкостях организма, в том числе в слизистой кишечника, желчного пузыря, лёгких, желчи, женской репродуктивной системе и костях [17].
В многочисленных клинических исследованиях продемонстрирована клиническая эффективность пиперациллина/тазобактама у взрослых пациентов и детей старше 12 лет при лечении инфекций нижних дыхательных путей, осложнённых и неосложнённых инфекций мочевыводящих путей, интраабдоминальных инфекций, инфекций кожи и мягких тканей, инфекций костей и суставов, гинекологических инфекций, септицемии, а также в комбинации с аминогликозидами бактериальных инфекций у пациентов с нейтропенией. У детей в возрасте 2–12 лет при интраабдоминальных инфекциях, в комбинации с аминогликозидами бактериальных инфекциях у пациентов с нейтропенией [14][18–23].
В августе 2023 году опубликованы результаты систематического обзора с метаанализом рандомизированных клинических исследований (РКИ) сравнения применения пиперациллин/тазобактама и карбапенемов у взрослых пациентов с тяжёлой бактериальной инфекцией (т. е. любой бактериальной инфекцией, требующей госпитализации), включавшего 31 РКИ, проведённое в период 1993–2021 гг. с общим количеством проанализированных случаев лечения более 7 тыс. [24]. В качестве первичного исхода оценивали 90‑дневную смертность от всех причин. Вторичными исходами были частота развития нежелательных явлений (НЯ), вторичных инфекций, грибковых суперинфекций и рисков селекции резистентных возбудителей, а также длительность госпитализации. Метаанализ продемонстрировал отсутствие статистически значимых различий в показателях смертности пациентов в группах сравнения: в группе пиперациллина/тазобактама летальность составила 6,8 %, в группе карбапенемов — 5,7 % (относительный риск (ОР): 1,16, 95 % ДИ: 0,94–1,43, p = 0,18, I2= 0 %). Анализ в субпопуляциях продемонстрировал, что на отсутствие различий в показателях летальности не влиял ни локус инфекции, ни иммунный статус пациента, ни вариант применяемого карбапенема.
Так же препараты оказались сравнимы и по профилю безопасности. В группе пиперациллин/тазобактама НЯ отмечены у 40,4 % пациентов, в группе карбапенемов — в 40,8 % случаев (ОР: 1,00, 98 % ДИ: 0,96–1,04, р= 0,99, I2 = 34 %). Риски развития вторичных инфекций также были сравнимы: в общей сложности вторичная инфекция развилась у 4,9 % пациентов в группе пиперациллина/тазобактама и у 4,3 % в группе карбапенемов (ОР: 1,13, 98 % ДИ: 0,77–1,65, p = 0,45, I2 = 21 %). Отсутствовали статистически значимые различия и по частоте выявления грибковых суперинфекций и случаям вторичной бактериальной резистентности: указанные случаи отмечены у 4,6 % пациентов в группе пиперациллина/тазобактама и 2,8 % группа карбапенемов (ОР: 1,60, 98 % ДИ: 0,97–2,64, p = 0,03, I2 = 13 %). Медиана длительность госпитализации в группе пиперациллин/тазобактама была сопоставима с таковой в группе карбапенемов (9 дней (интерквартильный размах (ИКР) 4–29 дней) и 8 дней (ИКР 5–18 дней), соответственно).
В недавно проведённом РКИ (Sun Y et al., 2023), оценивавшем выживаемость пациентов с сепсисом и септическим шоком на фоне стартовой терапии меропенемом и пиперациллин/тазобактамом, также не было получено статистически значимых различий между группами как по реанимационной (17,84 % против 16,39 % (р=0,22) и 28‑дневной (24,92 % против 25,56 %, р=0,36), так и по 90‑дневной летальности (32,95 % против 37,45 %, р=0,15) [25].
Приведённые выше результаты РКИ и их метаанализа демонстрируют, что при лечении тяжёлых инфекций пиперациллин/тазобактам и карбапенемы сравнимы как по эффективности в отношении выживаемости пациентов, так и профилю безопасности и рискам селекции резистентных возбудителей вне зависимости от локуса инфекции.
Таким образом, пиперациллин/тазобактам среди некарбапенемных β-лактамов является равноэффективной альтернативой карбапенемам при лечении тяжёлых инфекций, в том числе вызванных БЛРС-продуцентами. Также пиперациллин/тазобактам может быть использован при необходимости проведения деэскалации терапии карбапенемами [16][26][27].
Абсолютным противопоказанием к назначению пиперациллин/тазобактама является повышенная чувствительность к пиперациллину, тазобактаму, β-лактамным антибиотикам (в том числе, к пенициллинам и цефалоспоринам), к другим компонентам препарата и ингибиторам β-лактамаз, а также возраст до 2 лет. Применение при беременности возможно только по жизненным показаниям [14].
Стратегии дозирования
У взрослых и детей старше 12 лет рекомендуемая суточная доза составляет 12 г пиперациллина / 1,5 г тазобактама с кратностью внутривенного введения 3–4 раза в сутки и длительностью каждой инфузии не менее 20–30 минут. При снижении скорости клубочковой фильтрации менее 40 мл/мин требуется коррекция дозы [14].
В тоже время прерывистые режимы дозирования β-лактамных антибиотиков приводят к неоправданно высоким пикам и спадам концентрации лекарственных средств, потенциально более низких, чем минимальная ингибирующая концентрация (МИК) для патогенных микроорганизмов, что повышает вероятность неэффективности терапии, а также увеличивает риски появления резистентных организмов при воздействии субтерапевтических уровней антибиотиков [28].
Пиперациллин/тазобактам, как и другие β-лактамы, — время-зависимый антимикробный препарат: его эффективность повышается при более длительном превышении МИК [29]. В тоже время при увеличении доз антимикробных препаратов повышаются риски развития нежелательных лекарственных реакций [29][30].
С целью оптимизации фармакокинетики и фармакодинамики существующих противомикробных препаратов используют метод длительной инфузии. Метод позволяет создать концентрации антимикробных препаратов, превышающие МИК, что особенно актуально в случаях инфекций, вызванных микроорганизмами с более высокими значениями МИК [28].
Термин «длительная инфузия» включает как продлённую инфузию (инфузия продолжительностью 3–4 ч), так и непрерывную инфузию продолжительностью 24 часа. Длительная инфузия противопоставляется прерывистым инфузиям (прерывистое дозирование), которое определяется как инфузия лекарственного средства в течение 30–60 минут несколько раз в день [31].
Для оценки идеальной скорости инфузии β-лактамных антибиотиков было использовано математическое и имитационное моделирование. Результаты показали, что за счёт увеличения продолжительности инфузии достигаются концентрации β-лактамов, превышающие МИК, что повышает их эффективность [32][33].
Экспериментальные модели использования длительных инфузий β-лактамных антибиотиков на животных также продемонстрировали их превосходство над прерывистой инфузией в исследованиях in vitro и in vivo. Эффект достигался за счёт достижения более высоких концентраций антибиотиков в крови и интерстициальной жидкости, что приводило к более быстрому наступлению бактерицидного эффекта [34].
Клинические исследования подтверждают результаты, полученные в эксперименте. Так, метаанализ результатов 23 клинических исследований эффективности пролонгированных инфузий пиперациллина/тазобактама (Fawaz S. et al., 2020), включавший в общей сложности 3828 взрослых пациентов в критическом состоянии, продемонстрировал, что непрерывные/длительные инфузии у пациентов в критическом состоянии статистически достоверно увеличивали частоту клинического излечения (отношение шансов (ОШ) 1,56, 95 % ДИ 1,28–1,90, р=0,0001), снижали показатели смертности (ОШ 0,68, 95 % ДИ 0,55–0,84, р=0,0003), увеличивали вероятность микробиологического излечения (ОШ 1,52, 95 % ДИ 1,10– 2,11, р=0,01) и приводили к сокращению сроков госпитализации (средняя разница –1,27 дня, 95 % ДИ 2,45–0,08, р=0,04) [35].
Стабильность приготовленного раствора пиперациллин/тазобактама в течение 24 часов при хранении при температуре не выше 25°С позволяет реализовывать указанную тактику дозирования в клинической практике.
Экономические аспекты
Учитывая отсутствие статистически значимых различий в летальности, частоте вторичных инфекций, вероятности грибковых суперинфекций и рисках селекции резистентных штаммов, а также длительности госпитализации между карбапенемами и пиперациллином/тазобактамом у пациентов с тяжелыми инфекциями их экономическая эффективность напрямую зависит от стоимости самих альтернатив. В табл. 1 представлена разница в затратах на антимикробную терапию пиперациллином/тазобактамом, имипенем/циластатином, меропенемом и дорипенемом исходя из средневзвешенной стоимости согласно данным портала государственных закупок в 2023 г. [36]. В расчётах учитывали, что согласно методическим рекомендациям «Диагностика и антимикробная терапия инфекций, вызванных полирезистентными штаммами микроорганизмов (обновление 2022 г.)» в случаях тяжёлых инфекций, вызванных энтеробактериями-продуцентами БЛРС (под тяжёлыми формами инфекции понимают пневмонию тяжёлого течения, сепсис, септический шок) необходимо использовать повышенные дозы карбапенемов [16].
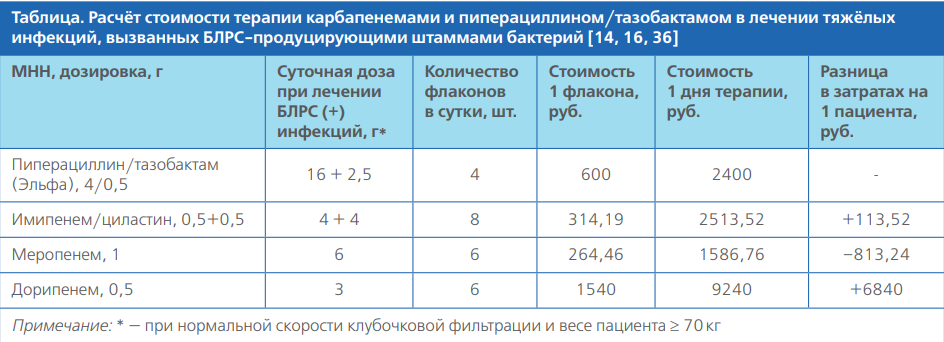
Исходя из данных, приведённых в таблице, видно, что применение пиперациллина/тазобактама в случаях тяжёлых инфекций, вызванных энтеробактериями-продуцентами БЛРС, является не только клинически, но и экономически оправданной стратегией. Так затраты на пиперациллин/тазобактам были ниже затрат на имипенем/циластин и дорипенем (–113,52 и –6840 руб., соответственно). Затраты на терапию меропенемом ниже затрат на пиперациллин/тазобактам (–33 %).
Выводы
1. Карбапенемы и пиперациллин/тазобактам в качестве антимикробной терапии тяжёлых инфекций сравнимы как по эффективности в отношении выживаемости пациентов, так и профилю безопасности и рискам селекции резистентных возбудителей вне зависимости от локуса инфекции.
2. Пиперациллин/тазобактам среди некарбапенемных β-лактамов является альтернативой карбапенемам при лечении тяжёлых инфекций, в том числе вызванных микроорганизмами-продуцентами β-лактамаз расширенного спектра действия, а также в случаях необходимости проведения деэскалации при терапии карбапенемами.
3. Пролонгированные инфузии пиперациллина/тазобактама у пациентов в критическом состоянии статистически достоверно увеличивали частоту клинического излечения, снижали показатели смертности, увеличивали вероятность микробиологического излечения и приводили к сокращению сроков госпитализации.
4. Применение пиперациллина/тазобактама в случаях тяжёлых инфекций, вызванных энтеробактериями-продуцентами БЛРС, является не только клинически, но и экономически оправданной стратегией.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов.
Автор декларирует отсутствие конфликта интересов.
Участие авторов. Гомон Ю.М. — написание текста, редактирование, оформление статьи.
ADDITIONAL INFORMATION
Conflict of interests.
The author declares no conflict of interest.
Participation of authors. Gomon YuM — text writing, editing, article design.
1. DDD — это средняя поддерживающая суточная доза лекарственного средства для взрослого человека массой тела 70 кг.
Список литературы
1. Устойчивость к антимикробным препаратам. Информационный бюллетень ВОЗ. 2019. Режим доступа: https://apps.who.int/gb/ebwha/pdf_files/WHA72/A72_R5-ru.pdf (Дата доступа: 20.09.2029).
2. Chou CH, Lai YR, Chi CY, Ho MW, Chen CL, Liao WC, Ho CM, Chen YA, Chen CY, Lin YT, Lin CD, Lai CH. Long-Term Surveillance of Antibiotic Prescriptions and the Prevalence of Antimicrobial Resistance in Non-Fermenting Gram-Negative Bacilli. Microorganisms. 2020 Mar 12;8(3):397. doi: 10.3390/microorganisms8030397. PMID: 32178340; PMCID: PMC7142802.
3. The Lancet Infectious Diseases. Antimicrobial resistance through the looking-GLASS. Lancet Infect Dis. 2023 Feb;23(2):131. doi: 10.1016/S1473-3099(23)00012-9. PMID: 36707218.
4. Butler MS, Gigante V, Sati H, Paulin S, Al-Sulaiman L, Rex JH, Fernandes P, Arias CA, Paul M, Thwaites GE, Czaplewski L, Alm RA, Lienhardt C, Spigelman M, Silver LL, Ohmagari N, Kozlov R, Harbarth S, Beyer P. Analysis of the Clinical Pipeline of Treatments for Drug-Resistant Bacterial Infections: Despite Progress, More Action Is Needed. Antimicrob Agents Chemother. 2022 Mar 15;66(3):e0199121. doi: 10.1128/ AAC.01991-21. Epub 2022 Jan 10. PMID: 35007139; PMCID: PMC8923189.
5. Whiles BB, Deis AS, Simpson SQ. Increased Time to Initial Antimicrobial Administration Is Associated With Progression to Septic Shock in Severe Sepsis Patients. Crit Care Med. 2017 Apr;45(4):623-629. doi: 10.1097/ CCM.0000000000002262. PMID: 28169944; PMCID: PMC5374449.
6. Seok H, Song J, Jeon JH, Choi HK, Choi WS, Moon S, Park DW. Timing of antibiotics in septic patients: a prospective cohort study. Clin Microbiol Infect. 2020 Nov;26(11):1495-1500. doi: 10.1016/j. cmi.2020.01.037. Epub 2020 Feb 14. PMID: 32062049.
7. Klein EY, Milkowska-Shibata M, Tseng KK, Sharland M, Gandra S, Pulcini C, Laxminarayan R. Assessment of WHO antibiotic consumption and access targets in 76 countries, 2000-15: an analysis of pharmaceutical sales data. Lancet Infect Dis. 2021 Jan;21(1):107-115. doi: 10.1016/S1473-3099(20)30332-7. Epub 2020 Jul 24. PMID: 32717205.
8. Захаренков И.А., Рачина С.А., Козлов Р.С., Белькова Ю.А. Потребление системных антибиотиков в России в 2017-2021 гг.: основные тенденции. Клиническая микробиология и антимикробная химиотерапия. 2022;24(3):220-225.
9. Гомон Ю.М., Колбин А.С., Арепьева М.А. с соавт. Потребление антимикробных препаратов в РФ (2008-2022 гг.): фармакоэпидемиологическое исследование. Клиническая микробиология и антимикробная химиотерапия. 2023. В печати
10. MacVane SH, Kuti JL, Nicolau DP. Prolonging β-lactam infusion: a review of the rationale and evidence, and guidance for implementation. Int J Antimicrob Agents. 2014 Feb;43(2):105-13. doi: 10.1016/j.ijantimicag.2013.10.021. Epub 2013 Nov 24. PMID: 24359838.
11. Schoonover LL, Occhipinti DJ, Rodvold KA, Danziger LH. Piperacillin/tazobactam: a new beta-lactam/ beta-lactamase inhibitor combination. Ann Pharmacother. 1995 May;29(5):501-14. doi: 10.1177/10600280 9502900510. PMID: 7655135.
12. Perry CM, Markham A. Piperacillin/tazobactam: an updated review of its use in the treatment of bacterial infections. Drugs. 1999 May;57(5):805-43. doi: 10.2165 /00003495-199957050-00017. PMID: 10353303.
13. Яковлев С.В. Комбинированная лекарственная форма пиперациллина с тазобактамом — тазоцин. Антибиотики и Химиотерапия. 1997;42(2):5-16.
14. Государственный реестр лекарственных средств. https://grls.rosminzdrav.ru/default.aspx
15. Кузьменков А.Ю., Виноградова А.Г., Трушин И.В., Эйдельштейн М.В., Авраменко А.А., Дехнич А.В., Козлов Р.С. AMRmap — система мониторинга антибиотикорезистентности в России. Клиническая микробиология и антимикробная химиотерапия. 2021;23(2):198-204. DOI: 10.36488/cmac.2021.2. 198-204.
16. «Диагностика и антимикробная терапия инфекций, вызванных полирезистентными штаммами микроорганизмов (обновление 2022 г.)». Режим доступа: https://association-ar.ru/wp-content/uploads/2022/03/%D0%9C%D0%A0-%D0%90%D0%91%D0%A2.pdf (Дата доступа: 20.09.2023).
17. Sörgel F, Kinzig M. Pharmacokinetics and tissue penetration of piperacillin/tazobactam with particular reference to its potential in abdominal and soft tissue infections. Eur J Surg Suppl. 1994;(573):39-44. PMID: 7524794.
18. Erasmo AA, Crisostomo AC, Yan LN, Hong YS, Lee KU, Lo CM. Randomized comparison of piperacillin/ tazobactam versus imipenem/cilastatin in the treatment of patients with intra-abdominal infection. Asian J Surg. 2004 Jul;27(3):227-35. doi: 10.1016/S1015-9584(09)60039-7. PMID: 15564167.
19. Figuera A, Rivero N, Pajuelo F, Font P, Leyra F, de La Cámara R, Arranz R, María Fernández Rañada J. Estudio comparativo de piperacilina/tazobactam frente a imipenem/cilastatina en la neutropenia febril (1994- 1996) [Comparative study of piperacillin/tazobactam versus imipenem/cilastatin in febrile neutropenia (1994- 1996)]. Med Clin (Barc). 2001 May 5;116(16):610-1. Spanish. doi: 10.1016/s0025-7753(01)71921-5. PMID: 11412645.
20. Ito I, Kadowaki S, Tanabe N, Haruna A, Kase M, Yasutomo Y, Tsukino M, Nakai A, Matsumoto H, Niimi A, Chin K, Ichiyama S, Mishima M. Tazobactam/piperacillin for moderate-to-severe pneumonia in patients with risk for aspiration: comparison with imipenem/ cilastatin. Pulm Pharmacol Ther. 2010 Oct;23(5):403- 10. doi: 10.1016/j.pupt.2010.05.007. Epub 2010 Jun 2. PMID: 20561917.
21. Naber KG, Savov O, Salmen HC. Piperacillin 2 g/tazobactam 0.5 g is as effective as imipenem 0.5 g/cilastatin 0.5 g for the treatment of acute uncomplicated pyelonephritis and complicated urinary tract infections. Int J Antimicrob Agents. 2002 Feb;19(2):95-103. doi: 10.1016/s0924-8579(01)00481-2. PMID: 11850161.
22. Saltoglu N, Dalkiran A, Tetiker T, Bayram H, Tasova Y, Dalay C, Sert M. Piperacillin/tazobactam versus imipenem/cilastatin for severe diabetic foot infections: a prospective, randomized clinical trial in a university hospital. Clin Microbiol Infect. 2010 Aug;16(8):1252-7. doi: 10.1111/j.1469-0691.2009.03067.x. Epub 2009 Oct 14. PMID: 19832720.
23. Titov I, Wunderink RG, Roquilly A, Rodríguez Gonzalez D, David-Wang A, Boucher HW, Kaye KS, Losada MC, Du J, Tipping R, Rizk ML, Patel M, Brown ML, Young K, Kartsonis NA, Butterton JR, Paschke A, Chen LF. A Randomized, Double-blind, Multicenter Trial Comparing Efficacy and Safety of Imipenem/Cilastatin/ Relebactam Versus Piperacillin/Tazobactam in Adults With Hospital-acquired or Ventilator-associated Bacterial Pneumonia (RESTORE-IMI 2 Study). Clin Infect Dis. 2021 Dec 6;73(11):e4539-e4548. doi: 10.1093/cid/ ciaa803. PMID: 32785589; PMCID: PMC8662781.
24. Munch MW, Granholm A, Jonsson AB, Sjövall F, Helleberg M, Hertz FB, Andersen JS, Steensen M, Achiam MP, Perner A, Møller MH. Piperacillin/tazobactam versus carbapenems in patients with severe bacterial infections: A systematic review with meta-analysis. Acta Anaesthesiol Scand. 2023 Aug;67(7):853-868. doi: 10.1111/aas.14239. Epub 2023 Mar 28. PMID: 36919866.
25. Sun Y, Liu Y, Wang J, Cui C. The effect of meropenem versus piperacillin-tazobactam in critically ill patients with sepsis and septic shock. Heliyon. 2023 May 20;9(6):e16542. doi: 10.1016/j.heliyon.2023.e16542. PMID: 37292309; PMCID: PMC10245158.
26. Karaiskos I, Giamarellou H. Carbapenem-Sparing Strategies for ESBL Producers: When and How. Antibiotics (Basel). 2020 Feb 5;9(2):61. doi: 10.3390/antibiotics9020061. PMID: 32033322; PMCID: PMC7167803.
27. Tamma PD, Rodriguez-Bano J. The Use of Noncarbapenem β-Lactams for the Treatment of Extended-Spectrum β-Lactamase Infections. Clin Infect Dis. 2017 Apr 1;64(7):972-980. doi: 10.1093/cid/cix034. PMID: 28362938; PMCID: PMC5848369.
28. MacGowan A. Revisiting Beta-lactams — PK/PD improves dosing of old antibiotics. Curr Opin Pharmacol. 2011 Oct;11(5):470-6. doi: 10.1016/j.coph.2011.07.006. Epub 2011 Aug 19. PMID: 21862409.
29. Turnidge JD. The pharmacodynamics of beta-lactams. Clin Infect Dis. 1998 Jul;27(1):10-22. doi: 10.1086/514622. PMID: 9675443.
30. Kanj SS, Kanafani ZA. Current concepts in antimicrobial therapy against resistant gram-negative organisms: extended-spectrum beta-lactamase-producing Enterobacteriaceae, carbapenem-resistant Enterobacteriaceae, and multidrug-resistant Pseudomonas aeruginosa. Mayo Clin Proc. 2011 Mar;86(3):250-9. doi: 10.4065/mcp.2010.0674. PMID: 21364117; PMCID: PMC3046948.
31. Rizk NA, Kanafani ZA, Tabaja HZ, Kanj SS. Extended infusion of beta-lactam antibiotics: optimizing therapy in critically-ill patients in the era of antimicrobial resistance. Expert Rev Anti Infect Ther. 2017 Jul;15(7):645- 652. doi: 10.1080/14787210.2017.1348894. Epub 2017 Jul 3. PMID: 28657373.
32. Lodise TP, Lomaestro BM, Drusano GL; Society of Infectious Diseases Pharmacists. Application of antimicrobial pharmacodynamic concepts into clinical practice: focus on beta-lactam antibiotics: insights from the Society of Infectious Diseases Pharmacists. Pharmacotherapy. 2006 Sep;26(9):1320-32. doi: 10.1592/ phco.26.9.1320. PMID: 16945055.
33. Lomaestro BM, Drusano GL. Pharmacodynamic evaluation of extending the administration time of meropenem using a Monte Carlo simulation. Antimicrob Agents Chemother. 2005 Jan;49(1):461-3. doi: 10.1128/ AAC.49.1.461-463.2005. PMID: 15616337; PMCID: PMC538854.
34. Kaufman SE, Donnell RW, Hickey WS. Rationale and evidence for extended infusion of piperacillin-tazobactam. Am J Health Syst Pharm. 2011 Aug 15;68(16):1521- 6. doi: 10.2146/ajhp100694. PMID: 21817083.
35. Fawaz S, Barton S, Nabhani-Gebara S. Comparing clinical outcomes of piperacillin-tazobactam administration and dosage strategies in critically ill adult patients: a systematic review and meta-analysis. BMC Infect Dis. 2020 Jun 20;20(1):430. doi: 10.1186/ s12879-020-05149-6. PMID: 32563242; PMCID: PMC7305614.
36. Единая информационная система в сфере закупок. (Режим доступа: https://zakupki.gov.ru/epz/main/pub-lic/home.html (Дата доступа: 20.09.2023).
Об авторе
Ю. М. ГомонРоссия
Гомон Юлия Михайловна — д. м. н., профессор кафедры клинической фармакологии и доказательной медицины
РИНЦ AuthorID: 835831
Санкт-Петербург
Рецензия
Для цитирования:
Гомон Ю.М. Пиперациллин-тазобактам: перспективы использования в реальной клинической практике. Реальная клиническая практика: данные и доказательства. 2023;3(3):1-7. https://doi.org/10.37489/2782-3784-myrwd-36. EDN: CUYJRQ
For citation:
Gomon Yu.M. Piperacillin-tazobactam: prospects for use in real-world practice. Real-World Data & Evidence. 2023;3(3):1-7. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-36. EDN: CUYJRQ






























