Перейти к:
Рекомендации по разработке определений использования лекарств с акцентом на реальные источники клинических данных
https://doi.org/10.37489/2782-3784-myrwd-54
EDN: BCTQUN
Аннотация
В настоящее время не существует единой установленной основы использования лекарственного средства в клинической практике. Данные рекомендации направлены на создание структуры, в которой изложены краткие соображения, необходимые учитывать при разработке определений использования лекарственных средств в реальной клинической практике. Особенностью представленной методики является использование двух определений: теоретического и практического. Теоретическое определение включает в себя структурирование информации о надлежащем или предпочтительном использовании лекарственного препарата, в соответствии с научными данными, инструкцией по применению и т.д. Практическое определение включает в себя структурирование собранных данных о применении лекарственного препарата в условиях реальной клинической практики. Структура призвана помочь исследователям более точно определить результаты фармакоэпидемиологических исследований.
Для цитирования:
Мотринчук А.Ш., Пчелинцев М.В. Рекомендации по разработке определений использования лекарств с акцентом на реальные источники клинических данных. Реальная клиническая практика: данные и доказательства. 2024;4(2):22-28. https://doi.org/10.37489/2782-3784-myrwd-54. EDN: BCTQUN
For citation:
Motrinchuk A.S., Pchelintsev M.V. Recommendations for developing drug use definitions with an emphasis on real-world data sources. Real-World Data & Evidence. 2024;4(2):22-28. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-54. EDN: BCTQUN
Введение / Introduction
Данные реальной клинической практики по использованию препаратов (англ. real-world data; RWD) всё чаще являются базой для получения значимых доказательств (англ. real-world evidence; RWE), которые помогают в принятии клинических и регуляторных решений. Однако существуют определённые требования, связанные с использованием этих данных, такие, как необходимость преобразования недостаточно структурированных данных о лекарственных средствах, полученных в ходе реальной клинической практики, для последующего научного анализа и использования [1].
Для этого важно создать теоретические и практические методы анализа использования лекарственных препаратов, чтобы помочь исследователям и научному сообществу в планировании, проведении, представлении и сравнении исследований.
Для разработки исследований по безопасности и эффективности лекарственных препаратов применяется системный подход [2]. Но, в настоящее время отсутствует установленная основа для осмысления и внедрения использования лекарственных препаратов.
Чтобы восполнить этот пробел, были созданы рекомендации, о которых говорится в данной статье. Рекомендации призваны помочь исследователям в понимании результатов фармакоэпидемиологических исследований. В представленных рекомендациях имеются две основные категории определений: теоретические определения, которые описывают предпочтительное использование лекарственного препарата, в соответствии с его свойствами, рекомендациями и т. д. и практические определения, которые описывают, как используется лекарство в реальной клинической практике. Эта концепция может предоставить исследователям более полное понимание использования лекарств и способствовать разработке новых подходов к анализу результатов применения лекарственных препаратов.
Соображения по теоретическому определению использования лекарственных препаратов
Предлагается пять ключевых соображений для разработки теоретического определения использования лекарственных препаратов (табл. 1).
Таблица 1. Рекомендации по разработке теоретического определения применения лекарственных препаратов Table 1. Recommendations for developing a theoretical definition of drug use |
1. Условия, в которых изучается препарат 1. Опишите, как применяется лекарственный препарат, который планируется включить в анализ (например, его экспозиция, результат использования и т. п.). 2. Укажите предпочтительный способ оценки использования (например, учёт, выписка рецептов, выплаты компенсаций, административные расходы). |
2. Концепция, интересующая исследователя Укажите, какой аспект, характеризующий лекарственный препарат находится в центре внимания (например, ингредиент лекарственного препарата, лекарственный препарат в целом, или класс лекарственных препаратов). |
3. Способы (пути) введения Опишите пути введения лекарственных препаратов, которые представляют интерес и/или, напротив, должны быть исключены. |
4. Интересующая доза лекарственного препарата 1. Опишите дозу лекарственного препарата: для каждого приёма, суточную дозу и/или предполагаемую курсовую дозу, если это применимо для исследования. 2. Опишите, как будет рассчитываться доза для различных лекарственных форм. |
5. Время и продолжительность приёма лекарственного препарата 1. Опишите, важны ли для результата исследования сроки применения лекарственного препарата. Дата начала приёма, продолжительность использования, соотношение времени применения лекарственного препарата с длительностью приёма других лекарств или значимого события, связанного со здоровьем пациента. Оценка длительности приёма: непрерывное применение, прекращение приёма в связи с теми или иными причинами, смена лекарственного препарата на другое. 2. Опишите, следует ли учитывать уровень приверженности лечению. 3. Опишите, ожидается ли сохранение действия препарата после прекращения лечения. |
Общие итоги теоретического определения:
1) Роль лекарственного препарата в исследовании: подумайте, является ли использование лекарственного препарата центральной переменной воздействия, ковариатой в исследовании, оценивающем эффективность или безопасность лечения, или исходом в исследовании, оценивающем итоги назначения.
2) Исследуемая популяция: различные эффекты лекарственных препаратов в разных популяциях часто представляют интерес для исследователей. Растёт количество исследований в узких областях. Исследователям следует учитывать клинические и демографические особенности исследуемых популяций.
Аспекты анализа теоретического определения:
1) Связанные с лекарственными препаратами: фокусируется ли исследование на конкретном компоненте, который может быть обнаружен более чем в одном лекарстве, конкретном лекарстве или классе лекарств, и представляет ли интерес повсеместное или случайное использование исследуемых лекарственных препаратов.
2) Связанные с путями введения: многие лекарственные препараты имеют различные показания и применяются в различных лекарственных формах и, соответственно, имеют различные пути введения. Например, кортикостероиды можно вводить разными путями и по множеству показаний. В концептуальном определении также должно быть отмечено, исключаются ли какие-либо способы введения.
3) Связанные с дозами лекарства (если это представляет интерес): теоретическое определение должно включать описание дозы для каждого пути введения, суточной дозы, а также предполагаемую курсовую дозу. Важно описать, как будет рассчитываться доза для различных лекарственных форм (например, парентеральных и пероральных). Исследователи также должны учитывать, что конкретные индивидуальные дозы некоторых препаратов очень трудно определить. Возможно, они захотят включить расчёты, учитывающие изменение дозы с течением времени [3].
4) Идеальное время и продолжительность применения лекарственных препаратов: соображения по анализу использования лекарств в исследовании зависят от задач, стоящих перед исследователем, и включают такие факторы, как дата начала применения лекарственного препарата, время его использования, тип приёма (непрерывный или курсовой приём), значимые события, связанные со здоровьем пациента, изменения в приёме лекарств (плохая переносимость лекарства, успех/неудача лечения). Важно учитывать, что эффект лекарственного препарата может сохраняться после прекращения лечения или, что могут быть перерывы в лечении лекарственным препаратом или периоды замены одного лекарственного препарата на другое. Это может повлиять на анализ результатов действия лекарственного препарата. Это также требует понимания фармакологических характеристик лекарственного препарата.
Соображения по практическому определению использования лекарственных препаратов
Предлагается пять ключевых соображений для создания практического определения использования лекарственного препарата. При этом ответы на теоретические соображения по использованию лекарственных препаратов служат основой для создания практического определения использования лекарственных препаратов (табл. 2). Например, действующее практическое определение массового использования лекарств будет отличаться от практического определения использования лекарств эпизодически.
Общие итоги практического определения:
1) Модель поведения пациента при обращении за медицинской помощью и заполнение медицинской документации в системе здравоохранения, приводящие к получению наблюдаемых данных: стратегия скрининга записей или случаев использования лекарственных средств должна основываться на формате, в котором данные о лекарственных средствах собираются и хранятся. Например, во время госпитализации данные о приёме лекарств пациентом могут собираться по-разному. Клинический персонал больницы информацию об использовании пациентом лекарств, вносит в электронную медицинскую карту (ЭМК), включая информацию о рецептах, выписанных врачом, о назначении лекарств в истории болезни, о выдаче лекарств в аптеках [4]. Клинический персонал больницы опрашивает пациентов о предыдущем и о текущем приёме лекарственных препаратов или смотрит информацию о рецептах, выписанных при предыдущей выписке из больницы. В амбулаторных условиях процесс отличается. Данные из систем оказания медицинской помощи (как стационарной, так и амбулаторной) могут быть преобразованы в общую базу данных, используемую для выставления счетов и оплаты за лекарства. Информация о применении лекарств в отчётах часто ограничивается указанием препарата, дозы и дня поставки.
2) Характеристики использованных источников данных (например, место хранения информации) и подход, использованный для идентификации используемого препарата: как показано на рисунке, идентификация лекарственного препарата требует нахождения вероятного места (например, конкретных таблиц/представлений данных и полей), где хранится соответствующая информация, связанная с лекарственными препаратами, которая изначально является неоднородной. Предполагается, чтобы решения о надлежащих источниках информации о лекарственных препаратах в первую очередь основывались на знании клинической практики и того, как данные создаются и сортируются (например, решение врача о назначении лекарства пациенту). Следует учитывать формат отсортированных данных. Например, административные данные и данные об исках структурированы, потому что поставщики услуг должны следовать определенным требованиям, чтобы получить оплату. Электронные медицинские карты часто несут в себе неструктурированную информацию. Информация о лекарствах может храниться в виде закодированных данных в структурированных полях, в виде текста в полуструктурированных полях или в виде клинических заметок в свободном тексте. Закодированные данные о лекарственных средствах могут иметь форму кодов для конкретных организаций, или могут включать стандартную терминологию или классификаторы (например, RxNorm, Multum, FirstDataBank). Независимо от того, хранится ли информация о лекарствах в виде кодов или в виде текста, необходимо предоставить дополнительные материалы, включая структурированные списки кодов или список текстовых строк, используемых для идентификации случаев использования интересующего лекарства. Аналогичным образом, при использовании информации из частично структурированных или неструктурированных данных важно сообщать практические определения и методы. Наконец, исследователи также должны описать, как они решали проблему недостающих данных и несоответствий, если были использованы несколько источников данных. В любом случае, исследователи могут рассмотреть возможность привлечения людей, обладающих опытом работы с конкретным используемым источником данных.
Аспекты анализа практического определения:
1) Временные параметры, связанные с использованием лекарственных препаратов. Способность определять различные аспекты времени применения лекарств является неотъемлемым компонентом вопросов фармакоэпидемиологических исследований. Исследователь должен описать, каким образом он определил дату начала приёма пациентом лекарственного препарата и время последующего использования этого препарата, дату прекращения приёма препарата. Необходимо указать, как была рассчитана продолжительность использования лекарственных препаратов, если это представляет интерес, и как можно объяснить пробелы в выдаче лекарств (например, из-за позднего обращения за медицинской помощью или наличия у пациента большого количества необходимого лекарственного препарата в объёме, превышающем курс приёма данного препарата).
2) Другие особенности применения лекарственных препаратов.
Следует определить особенности применения лекарственных препаратов, представляющие интерес.
3) Валидация алгоритма.
Если для идентификации лекарства использовался некий алгоритм, исследователи должны указать, был ли валидирован этот алгоритм [5].
Таблица 2. Рекомендации по разработке практического определения применения лекарственного препарата Table 2. Recommendations for developing a practical definition of drug use |
1. Основная модель поведения пациентов при обращении за медицинской помощью и её отражение в медицинской документации в системе здравоохранения 1. Опишите модель, которую использует врач для скрининга записей об использовании лекарств пациентами на основе выявленных моделей их поведения. Опишите, как происходит формирование документации в источнике данных.1 2. Опишите шаги, предпринятые для преобразования собранных данных в общую модель данных (например, отображение данных в процессе обучения). 3. Опишите формат (тип) записи использования медикаментов (например, заказ на медикаменты по рецепту, выдача по рецепту и т. д., допускается использование нескольких типов записи). |
2. Применяемый подход к описанию собранных данных и созданию характеристики источников данных, которые были использованы 1. Используйте знания, полученные в ходе клинической практики, о том, как происходит сбор данных и как они сортируются, для принятия решений относительно соответствующих источников информации о лекарствах в определённом источнике данных. 2. Используйте знания, полученные в ходе сбора и хранения данных об использовании лекарственных препаратов. 3. Включите структурированный список кодов или список строчных текстов, использованных для идентификации случаев применения лекарств, в качестве дополнительного материала к любым фотопротоколам и рукописям по исследованию. |
Временные факторы, связанные с использованием лекарств 1. Опишите, как были определены сроки использования лекарственного препарата (начало использования и последующее прекращение использования). 2. Опишите, как были сформулированы реальные сроки использования лекарственного препарата в условиях его практического применения (учитывая возможный переход пациента на приём другого лекарственного препарата или возникшее с пациентом значимое событие). 3. Как была рассчитана продолжительность приёма препарата. |
Другие особенности применения лекарственных препаратов 1. Опишите, как было определено, использует пациент ли лекарственный препарат на постоянной основе или эпизодически (по требованию). 2. Если лекарственный препарат был рекомендован пациенту принять однократно, опишите, как это было определено, соблюдалась ли рекомендация. 3. Если при назначении использовался индивидуальный расчёт дозы для пациента, то опишите то, как она была рассчитана, и имелась ли исходная информация о дозировании препарата. 4. Опишите, как обрабатывались записи с отсутствующей информацией о применении лекарственного препарата. 5. Если для оценки лечения данного пациента использовалось несколько источников данных, опишите, как обрабатывались несоответствия и потенциальные повторы. |
Проверка алгоритма 1. Приведите соответствующие ссылки или опишите порядок проверки проведённых действий. 2. Предоставьте показатели производительности, полученные в результате проверки. |
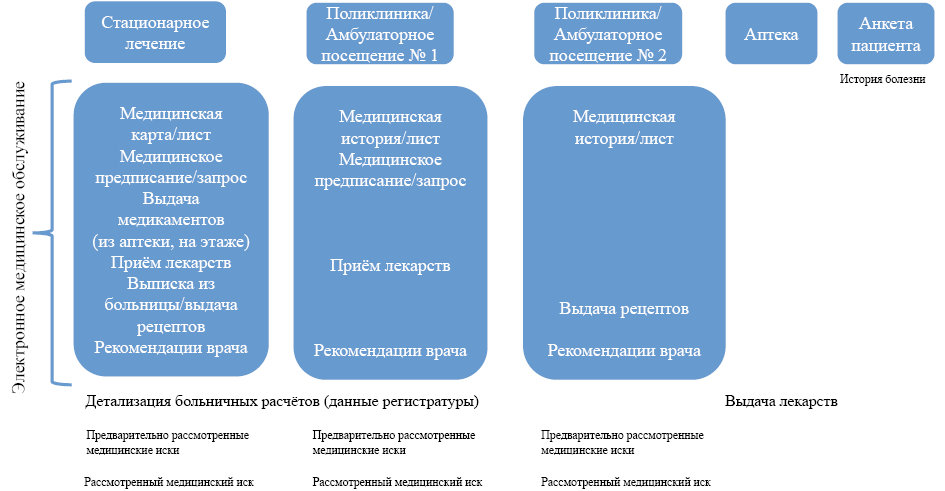
Рис. Характеристики источника данных, которые были использованы, и подход, использованный для идентификации используемого лекарственного средства
Fig. Characteristics of data sources and drug identification approaches
Обсуждения / Discussions
Всё более частое использование данных реальной клинической практики для принятия решений о безопасности и эффективности лекарственных препаратов требует решения проблем, связанных с особенностями анализа этих данных. Чтобы помочь исследователям понять сильные и слабые стороны различных подходов, предлагается использовать рекомендации по разработке определений применения лекарств с акцентом на источники клинических данных.
Описанные в статье рекомендации дополняют уже существующие, такие как STaRT-RWE [6], согласованный документ ISPE-ISPOR [7], RECORD-PE [8] и Руководство ENCEPP по методологическим стандартам [9]. Важно учесть особенности лекарственного препарата, его активное действующее вещество, дозировку, пути введения и длительность использования. Эти факторы важны при включении информации об использовании лекарств в клинические исследования. Принимая и используя изложенные соображения, можно повысить качество фармакоэпидемиологических исследований и улучшить качество анализа и интерпретации полученных результатов. Решение этих проблем имеет важное значение для эффективного включения результатов использования лекарственных препаратов в анализ данных реальной клинической практики и, в конечном итоге, для улучшения результатов лечения пациентов.
Выводы / Conclusions
Соображения в данных рекомендациях были разделены на две основные категории: теоретические определения, которые описывают оптимальное использование лекарственного препарата, и практические определения, которые объясняют, как использовались лекарственные препараты в реальной практике. Эта структура потенциально может предоставить исследователям более полное понимание использования лекарств и облегчить разработку новых подходов к анализу использования лекарств. Таким образом, данные рекомендации были созданы с целью помочь исследователям лучше понять результаты фармакоэпидемиологических исследований и улучшить качество анализа и интерпретации полученных результатов.
1. Модель данных — это совокупность функциональных характеристик объектов и особенностей представления информации.
Список литературы
1. Alishahi Tabriz A, Turner K, Hong YR, Gheytasvand S, Powers BD, Elston Lafata J. Trends and Characteristics of Potentially Preventable Emergency Department Visits Among Patients With Cancer in the US. JAMA Netw Open. 2023 Jan 3;6(1):e2250423. doi: 10.1001/jamanetworkopen.2022.50423.
2. Kuramoto LK, Sobolev BG, Rosner J, Brasher PMA, Azoulay L, Cragg JJ. A systematic, concept-based method of developing the exposure measure for drug safety and effectiveness studies. Pharmacoepidemiol Drug Saf. 2022 Jan;31(1): 13-21. doi: 10.1002/pds.5372.
3. Pazzagli L, Linder M, Zhang M, Vago E, Stang P, Myers D, Andersen M, Bahmanyar S. Methods for time-varying exposure related problems in pharmacoepidemiology: An overview. Pharmacoepidemiol Drug Saf. 2018 Feb;27(2):148-160. doi: 10.1002/pds.4372. Epub 2017 Dec 28. Erratum in: Pharmacoepidemiol Drug Saf. 2018 Mar;27(3):356. doi: 10.1002/pds.4414.
4. Gardarsdottir H, Souverein PC, Egberts TC, Heerdink ER. Construction of drug treatment episodes from drug-dispensing histories is influenced by the gap length. J Clin Epidemiol. 2010 Apr; 63(4):422-7. doi: 10.1016/j.jclinepi.2009.07.001.
5. Parker MM, Moffet HH, Adams A, Karter AJ. An algorithm to identify medication nonpersistence using electronic pharmacy databases. Journal of the American Medical Informatics Association : JAMIA. 2015 Sep;22(5):957-961. DOI: 10.1093/jamia/ocv054.
6. Wang SV, Pinheiro S, Hua W, Arlett P, Uyama Y, Berlin JA, Bartels DB, Kahler KH, Bessette LG, Schneeweiss S. STaRT-RWE: structured template for planning and reporting on the implementation of real world evidence studies. BMJ. 2021 Jan 12;372:m4856. doi: 10.1136/bmj.m4856.
7. Berger ML, Sox H, Willke RJ, Brixner DL, Eichler HG, Goettsch W, Madigan D, Makady A, Schneeweiss S, Tarricone R, Wang SV, Watkins J, Daniel Mullins C. Good practices for real-world data studies of treatment and/or comparative effectiveness: Recommendations from the joint ISPOR-ISPE Special Task Force on real-world evidence in health care decision making. Pharmacoepidemiol Drug Saf. 2017 Sep;26(9):1033-1039. doi: 10.1002/pds.4297.
8. Langan SM, Schmidt SA, Wing K, Ehrenstein V, Nicholls SG, Filion KB, Klungel O, Petersen I, Sorensen HT, Dixon WG, Guttmann A, Harron K, Hemkens LG, Moher D, Schneeweiss S, Smeeth L, Sturkenboom M, von Elm E, Wang SV, Benchimol EI. The reporting of studies conducted using observational routinely collected health data statement for pharmacoepidemiology (RECORD-PE). BMJ. 2018 Nov 14;363:k3532. doi: 10.1136/bmj.k3532.
9. Blake KV, Smeraldi C, Kurz X, Arlett P, Blackburn S, Fitt H. The European network of Centres for pharmacoepidemiology and pharmacovigilance: application to diabetes and vascular disease. Br J Diab Vasc Dis. 2011; 11: 304-307. doi:10.1177/1474651411422825.
Об авторах
А. Ш. МотринчукРоссия
Мотринчук Айтэн Шерифовна — ординатор кафедры клинической фармакологии и доказательной медицины
Санкт-Петербург
М. В. Пчелинцев
Россия
Пчелинцев Михаил Владимирович — к. м. н., доцент кафедры клинической фармакологии и доказательной медицины
Санкт-Петербург
Рецензия
РЕЦЕНЗИЯ на статью «Рекомендации по разработке определений использования лекарств с акцентом на реальные источники клинических данных» Мотринчук А.Ш., Пчелинцева М.В., ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова», Санкт-Петербург, Российская Федерация
- Краткое описание проблемы, которой посвящена статья.
В статье представлены авторские рекомендации по методике структурирования данных применения лекарственных препаратов в реальной клинической практике для последующего анализа. В ходе разработки данной авторской методики был использован международный опыт научных сообществ.
Особенностью представленной методики является использование двух определений: теоретического и практического.
Теоретическое определение включает в себя структурирование информации о надлежащем или предпочтительном использовании лекарственного препарата, в соответствии с научными данными, инструкцией по применению и т. д.
Практическое определение включает в себя структурирование собранных данных о применении лекарственного препарата в условиях реальной клинической практики.
Соответственно, «Соображения по теоретическому определению использования лекарственных средств» и «Соображения по практическому определению использования лекарственных средств» составляют два основных раздела статьи.
- Степеньактуальности рецензируемой статьи.
Актуальность статьи не вызывает сомнения в связи с тем, что данные реальной клинической практики по использованию препаратов все чаще являются базой для получения значимых доказательств, которые помогают в принятии клинических и регуляторных решений, а также в связи с тем, что в международном научном сообществе в настоящее время идет активная работа по созданию рекомендаций по сбору, структурированию и анализу данных, полученных в реальной клинической практике.
Представленная авторская методика является ценным вкладом в развитие общепринятого подхода к решению данного вопроса.
- Наиболееважные аспекты, раскрытые автором в статье.
Наиболее важными аспектами является описание двух определений: теоретического и практического. Это соответствует реальности, общепринятым принципам анализа данных в реальной практике, а также является авторским подходом.
Важно то, что в каждом из двух определений авторы детально представили их компоненты, такие как условия применения препарата, исследуемая научная концепция, способы введения, доза, временные характеристики, модель поведения пациентов, подход к описанию данных и т.д.
- Достоинстваи необходимые уточнения/изменения.
Безусловными достоинствами работы являются:
- обращениеавтора к самой теме разработки методики структуризации данных, полученных в реальной клинической практике
- оригинальная и эффективная предлагаемая методика
- структура статьи, в соответствии с которой каждое из предлагаемых определений (теоретическое определение и практическое определение) разбирается детально в трех подразделах: таблица с рекомендациями, общие итоги, аспекты анализа.
В то же время необходимо отметить аспекты, которые требуют уточнения и/или коррекции:
- тема и содержание статьи достаточно сложные, особенно для читателя, которые не имеет большого опыта в данной проблематике (сбор, структурирование, анализ данных, полученных в реальной практике); в связи с этим необходимо обратить внимание на стилистические аспекты изложения, например, на использование более конкретных формулировок, использование примеров.
- В Аннотации будет очень уместным краткое описание сути предлагаемой методики с упоминанием теоретического и практического определения.
- Имеющийся раздел «Выводы» по содержанию больше соответствует разделу «Обсуждение», которого в представленном манускрипте нет.
В связи с этим предлагаю переименовать раздел «Выводы» в «Обсуждение», расширить раздел за счет дополнительной информации об упоминаемых международных рекомендациях и руководствах STaRT-RWE, ISPE-ISPOR, RECORD-PE и ENCEPP, и создать новый раздел «Выводы», с заключением, более специфическим для предлагаемой авторской методики.
- По ходу текста внесены небольшие корректировки, а также комментарии.
- Рекомендация к публикации статьи.
Статья Мотринчук А.Ш., Пчелинцева М.В. «Рекомендации по разработке определений использования лекарств с акцентом на реальные источники клинических данных» соответствует требованиям, предъявляемым к работам подобного типа, отражает современные проблемы в области сбора и анализа медицинских данных, полученных в условиях реальной клинической практики, и может быть рекомендована к публикации в журнале «Реальная клиническая практика: данные и доказательства» после внесения изменений и дополнений, указанных выше и в виде комментариев в приложенном файле.
Для цитирования:
Мотринчук А.Ш., Пчелинцев М.В. Рекомендации по разработке определений использования лекарств с акцентом на реальные источники клинических данных. Реальная клиническая практика: данные и доказательства. 2024;4(2):22-28. https://doi.org/10.37489/2782-3784-myrwd-54. EDN: BCTQUN
For citation:
Motrinchuk A.S., Pchelintsev M.V. Recommendations for developing drug use definitions with an emphasis on real-world data sources. Real-World Data & Evidence. 2024;4(2):22-28. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-54. EDN: BCTQUN






























