Перейти к:
Компьютеризированные системы и базы данных для фармаконадзора в России
https://doi.org/10.37489/2782-3784-myrwd-60
EDN: KYAGES
Аннотация
Представлены результаты выявления новых рисков для компьютеризированных систем и баз данных для фармаконадзора в России, включая систему Росздравнадзора «Фармаконадзор/Мониторинг КИ ЛС». Отмечено отсутствие информации в единой базе данных по фармаконадзору Евразийского экономического союза и проблемы с обновлени ем программ и использованием альтернативных систем. Показаны изменения RWD/RWE-информации в глобальном фармаконадзоре за последние 5 лет.
Цель работы: установить наличие новых рисков для компьютеризированных систем и баз данных для фармаконадзора в России.
Материалы и методы. Материалы получены при опросе 138 специалистов по фармаконадзору и из нормативных правовых актов, публикаций, компьютеризированных систем и баз данных через открытые и авторизованные доступы. Использован социологический метод: опрос в Telegram-группе «Фармаконадзор СНГ» в октябре 2024 г. и информационно-аналитические методы: пользовательское тестирование, обзор и анализ российских и зарубежных систем и про грамм, включая базы данных для фармаконадзора, нормативную документацию и библиографию.
Результаты. 17 % специалистов по фармаконадзору используют в компьютеризированных системах и базах данных исключительно российское программное обеспечение, 29 % используют только зарубежные программы, 35 % исполь зуют одновременно российские и зарубежные программы, а 19 % затруднились с отнесением своих систем и программ к отечественным и иностранным. Результаты пользовательского тестирования указывают на наличие проблем и рисков с доступом к веб-системе фармаконадзора Росздравнадзора через зарубежные браузеры в актуальных версиях операци онных систем Windows, Android, MacOS, iOS и Unix. В единой базе данных по фармаконадзору Евразийского экономи ческого союза на 11.11.2024 г. нет сообщений в открытом доступе. За 5 лет изменился состав данных в EudraVigilance и VigiBase: наибольшее количество кейсов относится к ковидным вакцинам, а российские данные не включаются в EudraVigilance и VigiBase c 01.10.2020 г., что не позволяет учитывать их в глобальном анализе и работе с сигналами.
Заключение. Установлены новые потенциальные риски для компьютеризированных систем и баз данных для рос сийского фармаконадзора — несоответствие требованиям пригодности, хранения данных и качества проведения их анализа.
Ключевые слова
Для цитирования:
Романов Б.К., Сайкина Е.Н., Байдикова Е.Ю., Широкова У.М., Щукин Е.Д. Компьютеризированные системы и базы данных для фармаконадзора в России. Реальная клиническая практика: данные и доказательства. 2024;4(3):33-42. https://doi.org/10.37489/2782-3784-myrwd-60. EDN: KYAGES
For citation:
Romanov B.K., Saykina E.N., Baidikova E.Yu., Shirokova U.M., Shchukin E.D. Computerized systems and databases for pharmacovigilance in Russia. Real-World Data & Evidence. 2024;4(3):33-42. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-60. EDN: KYAGES
Актуальность / Relevance
Фармаконадзор (англ. pharmacovigilance; PV) — значимый источник данных из реальной клинической практики, но санкции ограничивают использование электронных систем [1], в том числе использование программного обеспечения и облачных сервисов [2].
Отсутствие публикаций по санкционным рискам для российского фармаконадзора и результатов по запросу «компьютеризированные системы для фармаконадзора» в русскоязычной библиографической системе eLibrary, а также отсутствие информации в PV-базе Евразийского экономического союза (далее — ЕАЭС) и изменения в составе данных за последние 5 лет в двух других значимых для российского фармаконадзора международных PV-базах: европейской (далее — EudraVigilance) и глобальной (далее — VigiBase) определяют актуальность оценки наличия новых рисков для электронных систем фармаконадзора в России, в том числе — для регуляторной системы Росздравнадзора «Фармаконадзор/Мониторинг КИ ЛС» версии 2.0 (далее — АИС 2.0) и российского фармаконадзора в целом, включая его отраслевой сектор и научные исследования.
Цель / Objective
Установить наличие новых рисков для компьютеризированных систем и баз данных для фармаконадзора в России.
Материалы и методы / Materials and methods
Материалы получены из опроса 138 специалистов по фармаконадзору и из нормативных документов, библиографических и компьютеризированных систем и баз данных через открытые и авторизованные доступы.
Использован социологический метод: опрос в Telegram-группе «Фармаконадзор СНГ» (t.me/pv_cis) с 8 по 18 октября 2024. Эта группа объединяет наибольшее количество русскоязычных специалистов по фармаконадзору (1967 участников на 13.11.2024 г.), в том числе уполномоченных лиц по фармаконадзору и представителей PV-вендоров [3]. Респондентов не распределяли на группы по занимаемой должности и опыту работы в фармаконадзоре, поскольку они анонимно давали один ответ на один вопрос о программном обеспечении (отечественное или зарубежное) в PV-системе своей организации (операционная система, браузер, корпоративная электронная почта и база PV-данных). Статистическую мощность опроса считали достаточной при условии превышения в нём количества респондентов в группах сходных исследований [4].
Также использованы информационно-аналитические методы: пользовательское тестирование компьютеризированных систем и баз данных, обзор и анализ нормативных актов и библиографии, отечественных и зарубежных операционных систем и программ, являющихся типовыми компонентами компьютеризированных систем и баз данных для фармаконадзора в России. Нормативный перечень включал в себя Решение Совета Евразийской экономической комиссии от 19.05.2022 № 81 «О внесении изменений в Правила надлежащей практики фармаконадзора Евразийского экономического союза» [5] (далее — Правила GVP ЕАЭС) и Приказ Росздравнадзора от 17.06.2024 № 3518 «Об утверждении Порядка фармаконадзора лекарственных препаратов для медицинского применения» [6] (далее — Приказ 3518), вступающий в силу с 01.03.2025 г. до 01.03.2031 г.
Материалы для обзора, тестирования и анализа компьютеризированных систем и PV-баз данных получены с использованием лицензионных и открытых операционных систем: Windows, Android, MacOS, iOS и Unix (различных версий и сборок) и российских и зарубежных интернет-браузеров, развёрнутых на стационарных и мобильных Intel, AMD, Android и Apple-совместимых устройствах, произведённых в 2012–2024 гг.: моноблок IRU Office 23IH6 2024 г. выпуска; 4 системных блока: Beelink SER 5 Pro 2024 г., Smart Sensor i5–2400 (с Wi-Fi USB-адаптером) 2023 г., MacMini 2014 и MacMini 2012 соответствующих годов выпуска c монитором HP M24fw; 2 ноутбука Asus: UX410UAK и UX310UAK 2018 г.; планшет iPad 8 gen 2020 г.; смартфоны: Samsung S23 2023 г. и iPhone 13 Pro Max 2022 г.; многофункциональные устройства (принтер, копир и сканер): лазерное HP MFP M28a и струйное Epson L3210. Тестирование проведено 5 специалистами разного уровня подготовки, умеющими разрабатывать базы данных для организации и вносить данные в АИС 2.0 [7]: 3 опытных пользователя и 2 программиста с опытом настройки различных систем и оборудования. Загрузочные USB-носители записывали в программе Rufus. Сетевой доступ оценивали по Wi-Fi от провайдеров Дом. ру и МГТС, LAN (RSMU) и мобильному Интернету (МТС). Оценивали пригодность систем, доступ и состав данных на пяти PV-ресурсах — АИС 2.0; PV-база ЕАЭС [8]; европейская PV-база EudraVigilance [9]; глобальная PV-база VigiBase через интерфейсы VigiAccess [10] и VigiLyze [11].
Результаты и обсуждение / Results and discussion
Результаты опроса об использовании российского и зарубежного софта в PV-системах: только 23 из 138 специалистов по фармаконадзору, принявших участие в опросе, сообщили, что используют в компьютеризированных системах и базах данных своих PV-систем исключительно российское программное обеспечение. 40 респондентов сообщили, что используют только зарубежные программы, а 48 опрошенных специалистов (наибольшее количество) отметили одновременное использование российского и зарубежного софта. Ещё 27 специалистов затруднились с отнесением систем и программ своих PV-систем к отечественным и иностранным (см. рис. 1). Это может быть связано с тем, что проверка программ, заявляемых на своих веб-сайтах, как российские, показала, что не все они зарегистрированы в Реестре российского программного обеспечения [12] и не все они стали доступными для российских пользователей после введения новых санкций 12.09.2024 г.
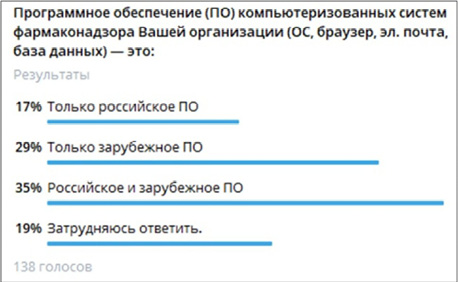
Рис. 1. Результаты опроса 138 специалистов по фармаконадзору
Fig. 1. Results of the survey of 138 pharmacovigilance specialists
Результаты пользовательского тестирования оценки пригодности различных компьютеризованных систем (совокупность программных и аппаратных компонентов) для выполнения рутинных PV-функций, выявления и оценки новых рисков: предустановленные операционные системы от компаний Microsoft, Google и Apple обеспечивали пригодность всех устройств для работы с базами данных, офисными и почтовыми программами, но не каждый встроенный в систему или позднее установленный зарубежный веб-браузер позволял работать с АИС 2.0 — не работал доступ из браузера Safary, но возможна работа из Яндекс. Браузера, Chrome, Edge, Firefox и Opera.
Рекомендации использовать браузеры с поддержкой российских сертификатов безопасности (Яндекс. Браузер или Атом) оказались частично выполнимыми, так как начиная с 13.09.2024 г., браузер Атом перестал быть доступным для скачивания и обновления на своём веб-сайте https://browser.ru.
По мнению авторов, наиболее пригодными для работы с российской и международными PV-базами в октябре и начале ноября 2024 г. были система Microsoft Windows и Яндекс. Браузер (приемлемые альтернативные браузеры: Google Chrom и Microsoft Edge).
Только в одной ситуации (выгрузка данных большого объёма из VigiLyze) более удобным и быстрым был планшет iPad с браузером Safary, но проведение поиска в VigiLyze на этом же планшете и на iPhone с Safary было наименее пригодным. На рис. 2 представлен интерфейс системы АИС 2.0 при работе с ней из Microsoft Edge:
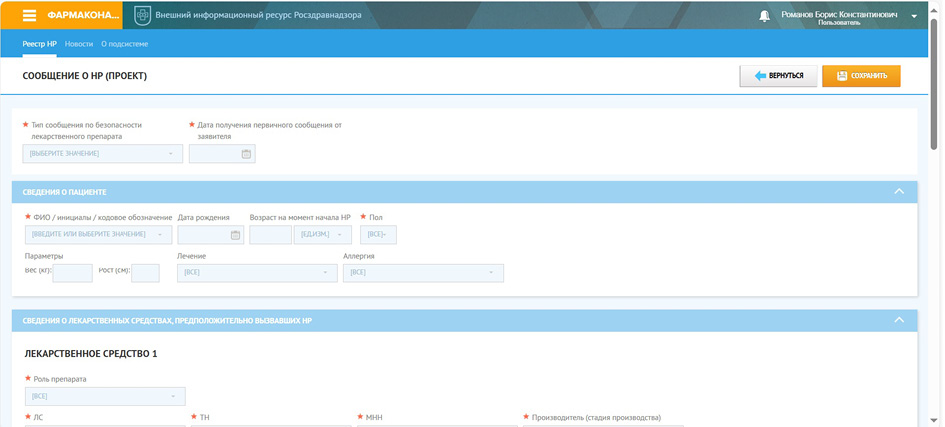
Рис. 2. Интерфейс российской национальной базы данных по фармаконадзору
Fig. 2. Interface of the Russian national pharmacovigilance database
Результаты оценки пригодности альтернативных открытых операционных систем: авторы не смогли получить полностью пригодные системы на указанном выше Intel-совместимом оборудовании с актуальными Unix-дистрибьютивами разных версий и сборок, полученными с веб-сайтов их разработчиков в октябре 2024 г.
Они не загружалась или требовали настройки, которая всё равно не приводила к работе без проблем (перечень которых мог бы составить отдельную публикацию).
Linux Mint (21–21.3 и 22) и Green Linux (21.1–22) показали чуть лучшие результаты на фоне других Unix-систем (включая заявляемые, как российские), но и у них была выявлена одна проблема, которую так и не удалось решить — с печатью на Epson L3210 под встроенными драйверами и под драйверами с веб-сайта Epson.
Новые сборки Linux Mint и Green Linux включают офисный софт для работы специалиста по фармаконадзору; они похожи на продукты Microsoft и между собой, так как Green Linux собран на основе Linux Mint и обе они собраны на основе Ubuntu, но различаются предустановленным браузером — Firefox на Linux Mint и Яндекс. Браузер на Green Linux и составом офисных программ: в Green Linux нет предустановленной системы управления базами данных, поэтому Linux Mint, по мнению авторов, более предпочтителен.
Данные сборки Linux могли быть пригодными на момент тестирования, но 23.10.2024 г. создатель Linux (Линус Торвальдс) подтвердил исключение всех 11 россиян из разработки ядра Linux (https://www.phoronix.com/news/Linus-Torvalds-Russian-Devs), поэтому авторы не исключают риска того, что в будущем эти системы потеряют свою пригодность для России. По мнению авторов, это следует учитывать при выборе систем для пользователей и организаций из России.
Таким образом, авторы не смогли подтвердить пригодность альтернативных систем для выполнения рутинных функций специалиста по фармаконадзору, но допускают, что на другом оборудовании они могли бы нормально инсталлироваться, настроиться и работать.
Оценка новых рисков в работе программ корпоративной электронной почты для коммуникации в системах фармаконадзора и планировщика задач выявила наличие проблем, связанных с требованием авторизации лицензионной продукции компании Microsoft (https://www.microsoft.com/ru-ru), которая 04.03.2022 г. приостановила все новые продажи продуктов и услуг в России, а все попытки полноценной замены авторами этих продуктов на свободно распространяемое программное обеспечение не стали успешными.
К концу 2024 г. Microsoft прекращает поддержку программ «Почта» и «Календарь», ранее встроенных в системы Windows 10 и Windows 11 и принудительно заменяет их на программу Outlook. Эта замена также требует создания новой или использования ранее созданной учётной записи Microsoft, что также может быть сопряжено с рисками для пользователей из России по указанной выше причине.
Остальные предустановленные программы электронной почты и офисные пакеты (кроме активации Microsoft 365 — новое название Microsoft Office) для стационарных и мобильных Intel, Android и Apple-совместимых устройств показали свою пригодность.
При оценке работы с Единой информационной базой данных по выявленным нежелательным реакциям (действиям) на лекарственные средства в составе Единого реестра и информационных баз данных Евразийского экономического союза было установлено, что по состоянию на 11.11.2024 г. в этой базе ещё не было ни одной записи в открытом доступе (см. рис. 3). Обращение к другим базам данных в этом Едином реестре показало, что все они работают медленно, с существенными задержками по открытию и запросам на тестируемом оборудовании и системах, что можно отнести к потенциальному риску затруднений при дальнейшей работе с ними. 28.10.2024 г. в Telegram-группе «Фармаконадзор СНГ» была размещена информация о сбое в работе компьютеризованной системы регулятора и национальной системы фармаконадзора Кыргызстана и на 11.11.2024 г. этот ресурс (https://www.pharm.kg) оставался недоступным.
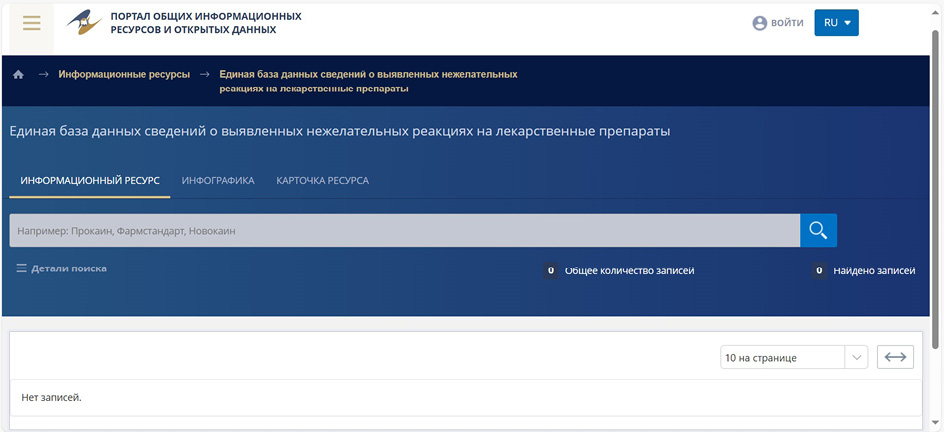
Рис. 3. Интерфейс базы данных ЕАЭС по фармаконадзору
Fig. 3. Interface of the EAEU pharmacovigilance database
Информация на веб-сайте европейского регулятора (EMA), в том числе PV-база данных EudraVigilance была доступна из всех тестируемых систем и браузеров. По мнению авторов, она полезна для российского фармаконадзора RWD/RWE-информацией и регуляторными данными о безопасности близкой или идентичной номенклатуры лекарственных средств, общими характеристиками лекарственных средств, планами минимизации рисков и другими важными документами и данными (см. рис. 4).
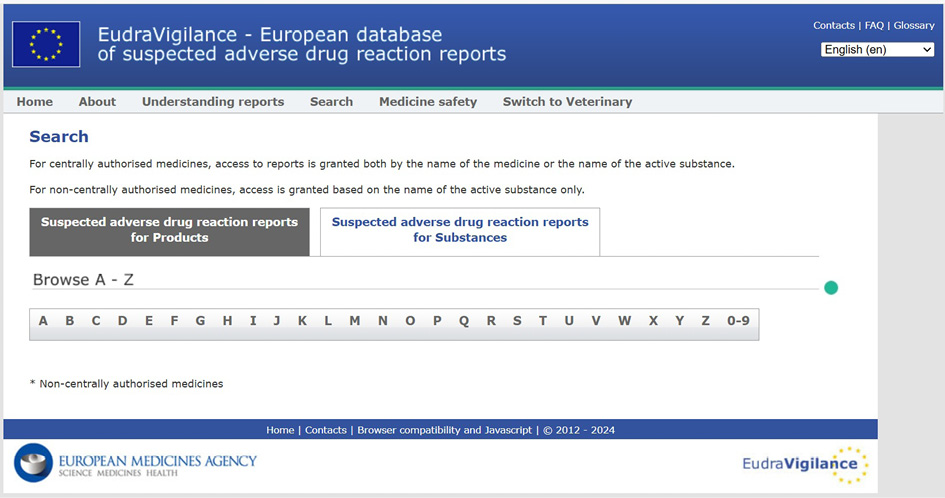
Рис. 4. Интерфейс европейской базы данных по фармаконадзору EudraVigilance
Fig. 4. Interface of the European pharmacovigilance database EudraVigilance
Глобальный фармаконадзор — это международная программа по изучению лекарственной безопасности, проводимая с 1968 г. Всемирной организацией здравоохранения, которая в 1978 г. делегировала её Уппсальскому центру мониторинга (UMC, Швеция), получающему, анализирующему и коммуницирующему информацию в своей PV-базе данных VigiBase. Данные в VigiBase отправляются из национальных сотрудничающих центров в 179 странах.
В настоящее время в режиме открытого доступа (через шлюз VigiAccess, см. рис. 5) можно получить из VigiBase обобщённую информацию, которая на 11.11.2024 г. включала в себя более 40,5 млн. кейсов, реконсилированных в регуляторном классификаторе MedDRA актуальной версии 27.1 (работа MedDRA в России ограничена с октября 2023 г.) — сообщений о случаях нежелательных явлений и реакций, поствакцинальных осложнений и побочных проявлений после иммунизации, микробной контаминации и недостаточном действии готовых лекарственных средств (малых молекул) и вакцин. Поиск данных в VigiAccess осуществляется при вводе международных непатентованных, группировочных и патентованных (торговых) наименований.

Рис. 5. Интерфейс VigiAccess глобальной базы данных по фармаконадзору VigiBase
Fig. 5. VigiAccess interface of the global pharmacovigilance database VigiBase
В VigiAccess открыт доступ не только к обобщённым абсолютным и относительным значениям количества репортируемых кейсов с их отнесением к уровням MedDRA, но и к графическим и табличным данным статистического анализа, которые ранее были доступны только через экспертный доступ к VigiBase через шлюз VigiLyze (см. рис. 6), в котором можно получить ещё и CIOMS-формы кейсов (отдельными PDF-файлами и в сводной Excel-таблице), результаты анализа качества кейсов (score), диспропорциональности, сведения о пострегистрационных исследованиях безопасности, данные о работе с сигналами по безопасности и аналитические обзоры глобального объёма данных о лекарственной безопасности (big data) — значимый источник RWD/RWE-информации.
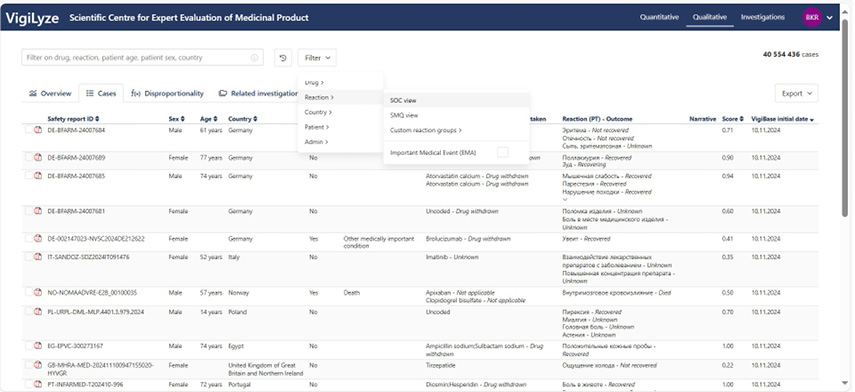
Рис. 6. Интерфейс VigiLyze глобальной базы данных по фармаконадзору VigiBase
Fig. 6. VigiLyze interface of the global pharmacovigilance database VigiBase
Глобальная PV-база данных VigiBase является наиболее полным источником данных о безопасности зарегистрированных лекарственных средств для медицинского применения и имеет развитые поисковые и аналитические инструменты. Последние 5 лет туда поступает в среднем 3 млн. кейсов ежегодно. Для сравнения — в российскую базу данных АИС 2.0 ежегодно поступает примерно 40 тысяч сообщений, это примерно в 100 раз меньше по количеству, чем поступает в VigiBase. Для многих стран мира VigiBase является единственной регуляторной PV-базой, которая получает данные через интерфейс VigiFlow.
За последние 5 лет, начиная с конца 2020 г., существенно изменился состав данных (как и в EudraVigilance): наибольшее количество кейсов теперь относится к ковидным вакцинам (14,4 % всех кейсов в VigiBase), которые вытеснили прежних «лидеров» рейтинга (ацетилсалициловую кислоту и парацетамол) на 2 и 3 место (2,7 % и 2,1 %, соответственно).
Российский регулятор также имеет доступ к этим данным, но, начиная с 10.10.2020 г., российские данные не включаются в VigiBase, и они никогда не включались в EudraVigilance. Это не позволяет учитывать их в инструментариях глобального анализа и несёт в себе следующие потенциальные риски: отключение России от VigiBase (минимальный уровень подтверждения участия страны в программе мониторинга — отправка хотя бы 1 кейса каждые 3 месяца), позднее выявление сигналов по безопасности и сложность доказательств их подтверждения, ограничение доступа к RWD/RWE-информации, а также риски ненадлежащего управления и минимизации рисков применения средств лекарственной терапии и профилактики (вакцины и др.).
17.01.2024 г. IT-провайдер VigiBase (компания Tietoevry) подвергся хакерской атаке, после которой VigiLyze на 14 суток перестал быть доступным извне. Но это не привело к потере и искажению информации в базе данных, поэтому UMC сообщила 02.02.2024 г., что работа глобальной системы фармаконадзора была полностью восстановлена (см. рис. 7).
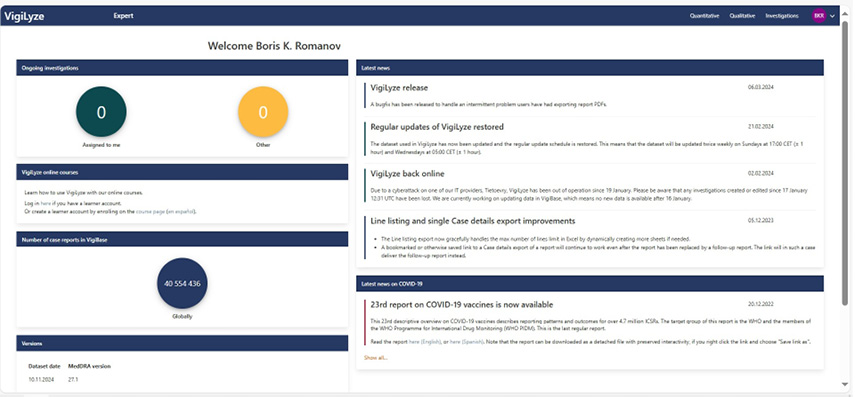
Рис. 7. Раздел новостей в VigiLyze
Fig. 7. Latest news in VigiLyze
В заключение авторы отмечают наличие проблем использования зарубежного программного обеспечения и облачных сервисов в российском фармаконадзоре и связанных с этим новых потенциальных рисков (являющихся частью глобальных проблем) по ненадлежащему выполнению требований Правил GVP ЕАЭС и Приказа 3518 (отсылающего к соблюдению Правил GVP ЕАЭС) по работе с электронными документами и хранению данных в PV-системах, в том числе по обеспечению совместимости форматов для своевременной передачи отчётных данных регуляторам (которые также находятся под этими рисками), требующих надлежащей валидации электронных PV-систем (для подтверждения их пригодности), защиты этих систем, доступа к данным и их резервного копирования, а также по сохранению всей информации в оригинальном формате и обеспечение сохранения её читаемости на протяжении всего времени хранения.
Полученные результаты соответствуют гипотезе исследования — появлению новых потенциальных рисков для компьютеризированных систем и баз данных для фармаконадзора в России: несоответствие требованиям пригодности, хранения данных и качества их анализа. Направления будущих исследований по дальнейшему выявлению и оценке этих рисков будут определяться появлением и развитием факторов, определяющих функционирование PV-систем в России.
Выводы / Conclusion
Установлены новые потенциальные риски для компьютеризированных систем и баз данных для российского фармаконадзора по несоответствию требованиям пригодности, хранения данных и качества их анализа при получении, реконсиляции и представлении информации о безопасности лекарственных средств.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Благодарности. Солодовникову Александру Геннадьевичу (ООО «Статэндокс») — за помощь в организации проведения опроса в Telegram-группе «Фармаконадзор СНГ».
Конфликт интересов
Авторы декларируют отсутствие конфликта интересов.
Финансирование
Работа выполнялась без спонсорской поддержки.
Участие авторов. Все авторы внесли существенный вклад в подготовку работы, прочли и одобрили финальную версию статьи перед публикацией. Романов Б. К. — пользовательское тестирование, написание текста, редактирование; Сайкина Е. Н. — пользовательское тестирование, написание текста, редактирование, оформление статьи; Байдикова Е. Ю. — пользовательское тестирование, написание текста, оформление статьи; Широкова У. М. — пользовательское тестирование, написание текста, оформление статьи; Щукин Е. Д. — пользовательское тестирование, статистическая обработка, написание текста, оформление статьи.
ADDITIONAL INFORMATION
Acknowledgements to Alexander Solodovnikov (Statandocs LLC) — for assistance in organizing the survey in the Telegram group t. me/pv_cis.
Conflict of interests
The authors declare no conflict of interest.
Funding
The work was carried out without sponsorship.
Authors’ participation. All the authors made a significant contribution to the preparation of the work, read and approved the final version of the article before publication. Romanov B. K. — testing, writing, editing; Saykina E. N. — testing, writing, editing, article design; Baidikova E. Yu. — testing, writing, article design; Shirokova U. M. — testing, writing, article design; Shchukin E. D. — testing, writing, article design.
Список литературы
1. Бочарников И.В. История антироссийских санкций: от Ивана Грозного до наших дней. URL: https://nic-pnb.ru/analytics/istoriya-antirossijskih-sanktsij-ot-ivana-groznogo-donashih-dnej (дата обращения: 11.11.2024).
2. Prohibition on Certain Information Technology and Software Services. Determination pursuant to section 1(a)(ii) of executive order 14071. URL: https://ofac.treasury.gov/media/932951/download?inline (дата обращения: 11.11.2024).
3. Телеграм-группа «Фармаконадзор СНГ». URL: https://t.me/pv_cis (дата обращения: 11.11.2024)
4. Голоенко Н.Г., Ягудина Р.И., Куликов А.Ю., Серпик В.Г., Проценко М.В., Карапетян Д.Г. Результаты социологического исследования по из учению информационной потребности специалистов системы мониторинга безопасности лекарственных препаратов в формировании мастер-файла системы фармаконадзора. Безопасность и риск фармакотерапии. 2020;8(2):84 89. doi: https://doi.org/10.30895/2312-7821-2020-8-2-84-89
5. Решение Совета Евразийской экономической комиссии от 19 мая 2022 г. No 81 «О внесении изменений в Правила надлежащей практики фармаконадзора Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01433831/err_09062022_81 (дата обращения: 11.11.2024)
6. Приказ Росздравнадзора от 17 июня 2024 г. № 3518 «Об утверждении Порядка фармаконадзора лекарственных препаратов для медицинского применения». URL: https://roszdravnadzor.gov.ru/drugs/monitpringlp/documents/84964 (дата обращения: 11.11.2024)
7. Фармаконадзор/Мониторинг КИ ЛС. Электронная база данных Автоматизированной информационной системы Росздравнадзора. URL: http://external.roszdravnadzor.ru (дата обращения: 11.11.2024)
8. Единая информационная база данных Евразийского экономического союза по выявленным нежелательным реакциям (действиям) на лекарственные средства, включающая со общения о неэффективности лекарственных средств. Электронная база данных программы мониторинга безопасности. URL: http://www.eurasiancommission.org/ru/act/texnreg/deptexreg/LSMI/Pages/LS_database.aspx (дата обращения: 11.11.2024)
9. EudraVigilance – European database of suspected adverse drug reaction reports. Электронная база данных европейской программы мониторинга безопасности. URL: https://www.adrreports.eu/en/search_subst.html (дата обращения: 11.11.2024).
10. VigiAccess. Электронная база данных (открытый доступ) глобальной программы мониторинга безопасности. URL: https://vigiaccess.org (дата обращения: 11.11.2024).
11. VigiLyze. Электронная база данных (экспертный доступ) глобальной программы мониторинга безопасности. URL: https://vigilyze.whoumc.org (дата обращения: 11.11.2024).
12. Реестр российского программного обеспечения. URL: https://reestr.digital.gov.ru (дата обращения: 11.11.2024)
Об авторах
Б. К. РомановРоссия
Романов Борис Константинович — д. м. н., доцент, зав. кафедрой фармакологии Института фармации и медицинской химии
Москва
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов.
Е. Н. Сайкина
Россия
Сайкина Екатерина Николаевна — аспирант кафедры фармакологии Института фармации и медицинской химии
Москва
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов.
Е. Ю. Байдикова
Россия
Байдикова Елизавета Юрьевна — студентка 3 курса Института фармации и медицинской химии
Москва
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов.
У. М. Широкова
Россия
Широкова Ульяна Максимовна — студентка 3 курса Института фармации и медицинской химии
Москва
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов.
Е. Д. Щукин
Россия
Щукин Егор Дмитриевич — студент 3 курса Института фармации и медицинской химии
Москва
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов.
Рецензия
Для цитирования:
Романов Б.К., Сайкина Е.Н., Байдикова Е.Ю., Широкова У.М., Щукин Е.Д. Компьютеризированные системы и базы данных для фармаконадзора в России. Реальная клиническая практика: данные и доказательства. 2024;4(3):33-42. https://doi.org/10.37489/2782-3784-myrwd-60. EDN: KYAGES
For citation:
Romanov B.K., Saykina E.N., Baidikova E.Yu., Shirokova U.M., Shchukin E.D. Computerized systems and databases for pharmacovigilance in Russia. Real-World Data & Evidence. 2024;4(3):33-42. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-60. EDN: KYAGES
JATS XML






























