Перейти к:
Обзор исследований реальной клинической практики применения капматиниба при раке лёгкого с мутацией МЕТ
https://doi.org/10.37489/2782-3784-myrwd-064
EDN: LWCLXM
Аннотация
Рак лёгкого занимает лидирующие позиции в структуре смертности от злокачественных новообразований, так в 2022 году смертность от рака лёгкого составила 31,66 на 100 тыс. населения, в 2022 г. 44 981 больных взято на учёт с впервые в жизни установленным диагнозом рак лёгкого, одногодичная летальность составляет 44,8 %. Одним из генов, участвующим в развитии опухолевых клеток рака лёгкого является ген МЕТ, в котором обнаружено несколько различных мутаций, однако именно делеция 14 экзона является наиболее часто встречающейся, эта мутация встречается в 3–4 % случаев немелкоклеточного рака лёгкого (НМЛР) и является независимым фактором плохого прогноза и ассоциирована с короткой общей выживаемостью. Лекарственный препарат капматиниб был впервые зарегистрирован в 2020 году именно для лечения НМРЛ при наличии делеции 14 экзона в гене МЕТ. Целью исследования является систематический обзор исследований реальной клинической практики капматиниба при НМРЛ.
Для цитирования:
Курылев А.А., Колбин А.С., Свечкарева И.Р. Обзор исследований реальной клинической практики применения капматиниба при раке лёгкого с мутацией МЕТ. Реальная клиническая практика: данные и доказательства. 2025;5(1):3-12. https://doi.org/10.37489/2782-3784-myrwd-064. EDN: LWCLXM
For citation:
Kurylev A.A., Kolbin A.S., Svechkareva I.R. Review of real-world studies on capmatinib use in MET-mutated lung cancer. Real-World Data & Evidence. 2025;5(1):3-12. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-064. EDN: LWCLXM
Актуальность / Relevance
Рак лёгкого — собирательное понятие, объединяющее различные по происхождению, гистологической структуре, клиническому течению и результатам лечения злокачественные эпителиальные опухоли [1]. По данным Каприна А. Д. и соавт. (2022 г.) заболеваемость злокачественными новообразованиями (ЗНО) трахеи, бронхов и лёгкого в 2022 году составила 39,14 на 100 тыс. населения. При этом рак лёгкого по-прежнему занимает лидирующие позиции в структуре смертности от ЗНО. Так, в 2022 году смертность от рака лёгкого составила 31,66 на 100 тыс. населения, а одногодичная летальность — 44,8 % [2][3]. При этом, в структуре рака лёгкого немелкоклеточный рак лёгкого (НМЛР) занимает около 85 %. В тоже время, НМЛР представляет собой гистологически неоднородную группу, в которой описаны ряд драйверных мутаций [4]. Одной из них является мутация в протоонкогене МЕТ (англ. mesenchymal — epithelial transition protooncogene) [5].
Ген МЕТ кодирует рецептор тирозинкиназы, экспрессируемый преимущественно эпителиальными клетками и стимулирует пролиферацию и регенерацию тканей [6]. Нарушение этого сигнального пути приводит к пролиферации клеток, инвазивному росту и метастазированию [7]. В опухолевых клетках, в генах которых отсутствует 14 экзон в гене МЕТ, наблюдается синтезирование укороченного варианта MET рецептора, что сопровождается его повышенной стабильностью и, следовательно, чрезмерной активацией МЕТ сигнального пути, что приводит к ускорению роста опухолевых клеток [8][9]. В гене МЕТ обнаружено несколько различных мутаций, однако именно делеция 14 экзона наблюдается в 3–4 % случаев НМЛР [10][11]. Вероятно, МЕТ мутация чаще встречается у пожилых пациентов, женщин и некурящих [12]. Ретроспективные исследования показывают, что наличие МЕТ мутации является независимым фактором плохого прогноза и ассоциирована с короткой общей выживаемостью (ОВ) [8, 9].
Лекарственный препарат капматиниб был впервые зарегистрирован в 2020 году именно для лечения НМРЛ при наличии делеции 14 экзона в гене МЕТ.
Цель / Objective
Цель исследования — проведение систематического обзора исследований реальной клинической практики капматиниба при НМРЛ.
Материалы и методы / Materials and methods
В поисковом ресурсе PubMed был выполнен систематический поиск исследований с использованием поискового запроса «capmatinib», а затем «capmatinib real-world». Схематическое представление процесса отбора исследований представлено на рис. 1.
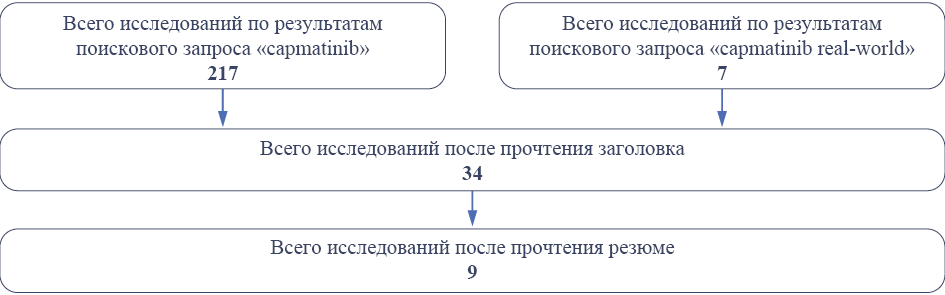
Рис. 1. Схематическое представление процесса отбора исследований
Fig. 1. Schematic representation of the study selection process
Характеристики отобранных на этапе систематического литературного поиска исследований приведены в табл. 1.
Результаты / Results
Как видно из данных, представленных в табл. 1, в отобранных для анализа 9 исследованиях, авторы использовали одни и те же критерии оценки эффективности проводимой терапии пациентам с НМРЛ и наличием мутации в гене МЕТ.
Вместе с тем, учитывая, что представленные исследования являются исследованиями реальной клинической практики они различаются по ряду характеристик целевой популяции пациентов, что, безусловно, оказывает влияние на итоговый результат.
Остальные из представленных в табл. 1. публикаций имеют единые критерии эффективности и их результаты соответствуют тому, чтобы быть включёнными в метаанализ.
Таблица 1. Характеристики, отобранных в результате систематического поиска исследований реальной клинической практики Table 1. Characteristics of studies identified from the systematic search of real-world studies | ||||
Автор, год | Дизайн, цель | Кол-во пациентов | Группы сравнения | Критерии эффективность |
Illini O et al., 2022 [13] | Ретроспективное, неинтервенционное, многоцентровое исследование реальной клинической практики. Цель: оценка эффективности капматиниба у пациентов с НМРЛ и мутацией в гене МЕТ, включенных в программу раннего расширенного доступа в странах ЕС. | Всего 81 пациент из них: · 37 пациентов, ранее не получавшие лекарственное лечение · 44 пациента, ранее получавшие лекарственное лечение | Исследование носило не сравнительный характер, группа контроля не предполагалась. Эффективность и безопасность оценивались в следующих группах: · все пациенты · пациенты, ранее не получавшие лекарственного лечения · пациенты, получавшие лекарственное лечение | · ЧОО · уровень контроля над заболеванием (сумма пациентов с полным и частичным ответом и стабилизацией заболевания) · ВБП · ОВ |
Kolaei et al., 2022 [14] | Описательное ретроспективное исследование, основанное на данных электронных медицинских карт и генетических исследований, выполненное в США. Цель: оценка эффективности химиотерапевтического лечения и применения иммуноонкологических ЛП у пациентов с НМРЛ и мутацией в гене МЕТ. | Всего 91 пациент, из них: · химиотерапевтическое лечение в 1-ой линии — 59 пациентов · иммунотерапия в 1-ой линии — 18 пациентов · химиотерапевтическое лечение в 2-ой линии — 16 пациентов · иммунотерапия во 2-ой линии — 23 пациента | Исследование носило несравнительный характер, группа контроля не предполагалась. Эффективность и безопасность оценивались в следующих группах: · химиотерапевтическое лечение, 1 линия; · иммунотерапия, 1 линия; · химиотерапевтическое лечение, 2 линия; · иммунотерапия 2 линия | · ВБП в 1 и 2 линиях · ОВ в 1 и 2 линиях |
Furkan M et al., 2024 [15] | Ретроспективное неинтервенционное когортное исследование пациентов с НМЛР с мутацией в гене МЕТ. Цель: оценка эффективности химиотерапевтического лечения и применения иммуноонкологических ЛП у пациентов с НМРЛ и мутацией в гене МЕТ, а также эффективности капматиниба | Всего в исследовании приняли участие 287 пациентов, из них: · получали капматиниб — 146 пациентов · получали иммунотерапию — 48 пациентов · получали химиотерапевтическое лечение — 30 пациентов · иммунотерапию и химиотерапевтическое лечение — 63 пациента | Исследование носило неинтервенционный характер, группа контроля не предполагалась. Эффективность и безопасность оценивались в следующих группах: · капматиниб · иммунотерапия · химиотерапевтическое лечение · иммунотерапия + химиотерапевтическое лечение | · ЧОО · уровень контроля над заболеванием (сумма пациентов с полным и частичным ответом и стабилизацией заболевания) · время на терапии (от момента начала лечения до его прекращения или смерти) · ВБП · ОВ |
Wolf J et al., 2023 | Многоцентровое ретроспективное неинтервенционное исследование данных электронных медицинских карт. Цель: изучение характеристик популяции пациентов с НМРЛ и мутацией в гене МЕТ, а также показателей выживаемости. | В исследование вошли 211 пациентов, из которых у 157 была выявлена делеция 14 экзона в гене МЕТ из них: · делеция 14 экзона в гене МЕТ, получали ЛП из группы МЕТ ингибиторов — 49 пациентов · другие мутации в гене МЕТ, получали ЛП из группы МЕТ ингибиторов — 7 пациентов; · делеция 14 экзона в гене МЕТ, не получали ЛП из группы МЕТ ингибиторов — 108 пациентов · другие мутации в гене МЕТ, не получали ЛП из группы МЕТ ингибиторов — 47 пациентов | Исследование носило неинтервенционный характер, группа контроля не предполагалась. Эффективность и безопасность оценивались в следующих группах: · делеция 14 экзона в гене МЕТ, получали ЛП из группы МЕТ ингибиторов · другие мутации в гене МЕТ, получали ЛП из группы МЕТ ингибиторов · делеция 14 экзона в гене МЕТ, не получали ЛП из группы МЕТ ингибиторов · другие мутации в гене МЕТ, не получали ЛП из группы МЕТ ингибиторов | · демографические, гистологические и молекулярно-генетические характеристики групп пациентов в режиме описательной статистики · общая выживаемость |
Paik PK et al., 2023 [17] | Ретроспективное неинтервенционное когортное исследование пациентов с метастатическим поражением головного мозга при НМРЛ и делецией 14 экзона в гене МЕТ Цель: оценка эффективности в исследуемой когорте пациентов в условиях реальной клинической практики | В исследование вошли 211 пациентов, из них: · капматиниб 1 линия — 55 пациентов · капматиниб 2 линия — 13 пациентов · иммунотерапия 1 линия — 11 пациентов · иммунотерапия 2 линия — 4 пациента | Исследование носило неинтервенционный характер, группа контроля не предполагалась. Эффективность и безопасность оценивались в следующих группах: · капматиниб 1 линия · капматиниб 2 линия · иммунотерапия 1 линия · иммунотерапия 2 линия | · ЧОО · уровень контроля над заболеванием (сумма пациентов с полным и частичным ответом и стабилизацией заболевания) · время на терапии (от момента начала лечения до его прекращения или смерти) · ВБП · ОВ |
Skribek M et al., 2023 [18] | Ретроспективное когортное исследование пациентов с метастатическим НМРЛ и делецией 14 экзона в гене МЕТ. Цель: изучение характеристик популяции пациентов с НМРЛ и мутацией в гене МЕТ, а также показателей выживаемости. | В исследование вошли 50 пациентов, которые были разделены на группы в зависимости от проведенной лекарственной терапии: · получали/не получали химиотерапевтическое лечение · получали/не получали иммунотерапию · получали/не получали ингибиторы МЕТ | Исследование носило неинтервенционный характер, группа контроля не предполагалась. Эффективность и безопасность оценивались в следующих группах: · химиотерапевтическое лечение — 27 пациентов · иммунотерапия — 27 па- циентов · ингибиторы МЕТ — 27 па- циентов | · ОВ |
Wolf J et al., 2020 | Исследование GEOMETRY mono-1 — нерандомизированное исследование 2 фаза лекарственного препарата капматиниб в популяции пациентов с НМРЛ и мутациями в гене МЕТ. Цель: непрямое сравнение ВБП и ОВ пациентов, получающих иммунотерапию или химиотерапевтическое лечение, по данным реальной клинической практики с группой пациентов, получающих в первой линии капматиниб (из исследования GEOMETRY mono-1). | В исследование вошли 50 пациентов, которые были разделены на группы в зависимости от проведенной лекарственной терапии: · капматиниб · группа реальной клинической практики | Исследование носило неинтервенционный характер непрямого сравнения, группа контроля не предполагалась. Эффективность и безопасность оценивались в следующих группах: · капматиниб — 28 пациентов · группа реальной клинической практики — 14 пациентов | · ВБП · ОВ |
Wolf J et al., 2022 [19] | Исследование GEOMETRY mono-1 — нерандомизированное исследование 2 фаза лекарственного препарата капматиниб в популяции пациентов с НМРЛ и мутациями в гене МЕТ. Цель: исследование исходов, сообщаемых пациентами — качества жизни. | В исследование вошли 97 пациентов, из них: · капматиниб 1 линия — 28 пациентов · капматиниб 2 линия — 69 пациентов | Исследование не предполагало группу контроля, т. к. имело дизайн однорукавного. Качество жизни оценивали в группах пациентов: · капматиниб 1 линия · капматиниб 2 линия | Исследование качества жизни по критериям: · European Organisation for Research and Treatment of Cancer (EORTC) QoL questionnaire — core 30 questionnaire (QLQ-C30) · EORTC QoL questionnaire — lung cancer module (QLQ-LC13) · EuroQol 5 dimension, 5 level questionnaire (EQ-5D-5L) |
Babey H et al., 2023 | Ретроспективное неинтервенционное исследование пациентов с НМРЛ и делецией 14 экзона в гене МЕТ. Цель: оценить эффективность лечения исследуемой когорты пациентов по данным реальной клинической практики. | Всего в исследование вошли 118 пациентов, из которых: · получали/не получали лечение кризотинибом — 55 и 51 пациент, соответственно · получали/не получали терапию ингибиторами тирозинкиназ — 78 и 28 пациентов, соответственно | В исследовании осуществлялось сравнение следующих групп пациентов: · химиотерапевтическое лечение (n=69) · иммунотерапия (n=12) · кризотиниб (n=15) · другие ингибиторы тирозинкиназ (n=12) Отдельно анализировалась эффективность в 1–4 линиях терапии. | · ЧОО · время на терапии (от момента начала лечения до его прекращения или смерти) · ОВ |
Сокращение: ЧОО — частота объективного ответа; ВБП — выживаемость без прогрессирования; ОВ — общая выживаемость; НМРЛ — немелкоклеточный рак лёгкого; МЕТ — mesenchymal — epithelial transition protooncogene; ЛП — лекарственные препараты. Abbreviations: ORR — objective response rate; PFS — progression-free survival; OS — overall survival; NSCLC — non-small cell lung cancer; MET — mesenchymal — epithelial transition protooncogene; MP — medicinal products. | ||||
Общими критериями эффективности, подходящими для метаанализа исследований, являются:
- частота объективного ответа (ЧОО);
- уровень контроля над заболеванием (сумма пациентов с полным и частичным ответом и стабилизацией заболевания);
- время на терапии (от момента начала лечения до его прекращения или смерти);
- выживаемость без прогрессирования (ВБП);
- общая выживаемость (ОВ).
В исследовании Kolaei et al., 2022 [14] ОВ и ВБП оценивались отдельно в первой и второй линиях терапии, но в других работах, вошедших в анализ, такое разделение авторами не было предусмотрено, учитывая этот факт при проведении метаанализа было выполнено два сценария:
- с учётом объединённых данных первой и второй линий по исследованию Kolaei et al., 2022 г. [14];
- без учёта результатов исследования Kolaei et al., 2022 г. [14].
Данные по критериям эффективности, представленным во включённых в метаанализ исследованиях, приведены в табл. 2.
Таблица 2. Эффективность терапии НМРЛ с мутацией в гене МЕТ Table 2. Efficacy of therapy for NSCLC with mutation in the MET gene | ||||||
Автор, год | Группа сравнения | ЛП | ЧОО (%) | Уровень контроля над заболеванием | Медиана ВБП, мес. (95 % ДИ) | Медиана ОВ, мес. (95 % ДИ) |
Illini O et al., 2022 [13] | Первичные и ранее получавшие лечение пациенты | капматиниб | 58 % (95 % ДИ: 47–69) | 81(95 % ДИ: 70–88) | 9,5 (95 % ДИ: 4,7–14,3) | 18,2 (95 % ДИ: 13,2–23,1) |
Kolaei et al., 2022 [14] | Первая линия | ХТ | Не оценивалась | Не оценивался | 5,7 (95 % ДИ: 4,6–7,1) | 20,0 (95 % ДИ: 10,9–24,6) |
иммунотерапия | 2,4 (95 % ДИ: 1,4–3,2) | Не достигнута | ||||
Вторая линия | ХТ | 3,5 (95 % ДИ: 1,9–11,1) | 15,3 (95 % ДИ: 4,0–41,1) | |||
иммунотерапия | 4,7 (95 % ДИ: 2,8–12,9) | 19,3 (95 % ДИ: 11,0 — НД) | ||||
Furkan M et al., 2024 [15] | Все пациенты | капматиниб | 73,4 (95 % ДИ: 65,2–80,5) | 95,0 (95 % ДИ: 89,9–98,0) | НД | НД |
ХТ | 52,0 (95 % ДИ: 31,3–72,2) | 84,0 (95 % ДИ: 63,9–95,5) | 10,1 (95 % ДИ: 5,9 — НД) | 17,6 (95 % ДИ: 10,9 — НД) | ||
иммунотерапия | 68,8 (95 % ДИ: 53,8–81,3) | 87,5 (95 % ДИ: 74,8–95,3) | 12,6 (95 % ДИ: 11,1 — НД) | НД (95 % ДИ: 14,3 — НД) | ||
Автор, год | Группа сравнения | ЛП | ЧОО (%) | Уровень контроля над заболеванием | Медиана ВБП, мес. (95 % ДИ) | Медиана ОВ, мес. (95 % ДИ) |
Wolf J et al., 2023 [16] | Любые линии терапии | получали ингибиторы MET | Не оценивалась | Не оценивался | Не оценивалась | 25,3 (17,8–38,7) |
не получали ингибиторы MET | 8,9 (7,4, — 11,5) | |||||
Paik PK et al., 2023 [17] | Любые линии терапии | капматиниб | 85,3 (95 % ДИ: 74,6–92,7) | 94,1 (95 % ДИ: 85,6–98,4) | 14,1 (95 % ДИ: 10,1 — НД) | НД (95 % ДИ: НД — НД) |
иммунотерапия | 53,3 (95 % ДИ: 26,6–78,3) | 73,3 (95 % ДИ: 44,9–92,2) | 5,1 (95 % ДИ: 3,0–11,1) | 14,1 (95 % ДИ: 13,9 — НД) | ||
Skribek M et al., 2023 [18] | Любые линии терапии | ХТ | Не оценивалась | Не оценивалась | Не оценивалась | 17 (95 % ДИ: 9,7 — НД) |
иммунотерапия | 18 (95 % ДИ: 16,5 — НД) | |||||
ингибитор МЕТ (капматиниб, кризотиниб) | 17 (95 % ДИ: 9,5 — НД) | |||||
Wolf J et al., 2020 | Любые линии терапии | ХТ и иммунотерапия | Не оценивалась | Не оценивалась | 6,1 (95 % ДИ: 3,4–8,1) | 20,0 (95 % ДИ: 7.2 — НД) |
капматиниб | 12,0 (95 % ДИ: 5,5–20,7) | 20,8 (95 % ДИ: 12,4 — НД) | ||||
Babey H et al., 2023 | Любые линии терапии | получали ингибитор МЕТ (кризотиниб и другие) | 50,8 % | 69,1 % | Не оценивалась | 27,1 (95 % CI 18–29,7) |
не получали ингибитор МЕТ | - | - | - | 35,6 (95 % CI 8,6 — НД) | ||
Сокращения: ХТ — химиотерапия; ДИ — доверительный интервал; ЧОО — частота объективного ответа; ВБП — выживаемость без прогрессирования; ОВ — общая выживаемость; МЕТ — mesenchymal — epithelial transition protooncogene; ЛП — лекарственные препараты; НД — не достигнут. Abbreviations: CT — chemotherapy; CI — confidence interval; ORR — objective response rate; PFS — progression-free survival; OS — overall survival; MET — mesenchymal — epithelial transition protooncogene; MP — medicinal products; ND — not reached. | ||||||
Как видно, исходя из данных, представленных в табл. 2, не все включенные в обзор исследования могут быть использованы для выполнения метаанализа прежде всего по причине отсутствия группы сравнения и их наблюдательного характера.
Сравнение по критерию «частота объективного ответа». В то же время по критерию ЧОО и уровню контроля над заболеванием по результатам исследований Furkan M et al., 2024 [15] и Paik PK et al., 2023 [17] возможно выполнить метаанализ для сравнения в паре капматиниб — иммунотерапия.
Результаты метаанализа в паре капматиниб — иммунотерапия по критерию ЧОО приведены на рис. 2.
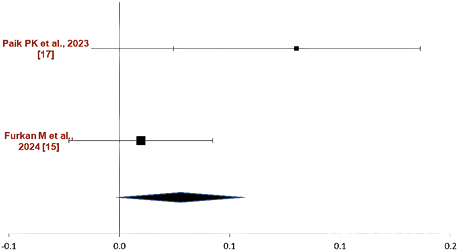
Рис. 2. Результаты метаанализа в группе сравнения капматиниб — иммунотерапия по критерию «частота объективного ответа»
Fig. 2. Results of the meta-analysis in the comparison group of capmatinib — immunotherapy according to the criterion of “objective response rate”
Как видно исходя из данных, представленных на рис. 1. капматиниб характеризуется большей ЧОО в сравнении с иммунотерапией (Q=4,59; p=0,0322; I2=78,2 %).
Сравнение по критерию «уровень контроля над заболеванием». Результаты метаанализа в паре капматиниб — иммунотерапия по критерию «уровень контроля над заболеванием» приведены на рис. 2.
Как видно, исходя из данных, представленных на рис. 2, капматиниб характеризуется большим уровнем контроля над заболеванием в сравнении с иммунотерапией, при этом отмечалась низкая гетерогенность включенных исследований (Q=1,58; p=0,20; I2=36,8 %).
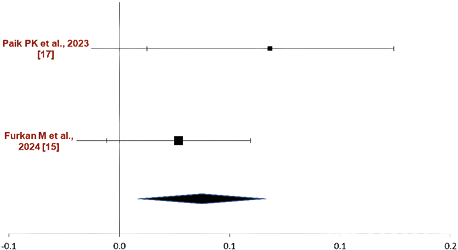
Рис. 3. Результаты метаанализа в группе сравнения капматиниб — иммунотерапия по критерию «уровень контроля над заболеванием»
Fig. 3. Results of the meta-analysis in the comparison group of capmatinib — immunotherapy according to the criterion “level of disease control”
Сравнение по критерию «выживаемость без прогрессирования». В большинстве исследований по критерию ВБП верхняя граница 95 % ДИ не достигнута, что не позволяет выполнить метаанализ таких исследований. На рис. 3 приведено наивное сравнение медиан ВБП, полученных в различных исследованиях.
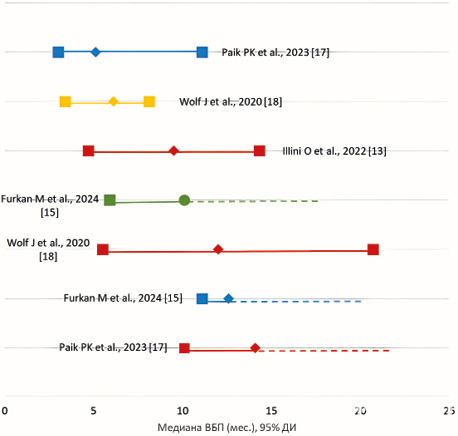

Рис. 4. Результаты наивного сравнения различных режимов лечения НМРЛ с мутацией в гене МЕТ по критерию «медиана выживаемости без прогрессирования» (мес.)
Fig. 4. Results of a naive comparison of different treatment regimens for NSCLC with a mutation in the MET gene according to the criterion of “median progression-free survival” (months)
Как видно, исходя из данных, представленных на рис. 4, применение капматиниба характеризуется тенденцией к более длительной медиане ВБП, в тоже время оценить статистическую достоверность различий невозможно по причине дизайна исследований реальной клинической практики.
Сравнение по критерию «общая выживаемость». В большинстве исследований по критерию ОВ медиана и верхняя граница 95 % ДИ не достигнута, что не позволяет выполнить метаанализ таких исследований. На рис. 5 приведено наивное сравнение медиан ОВ, полученных в различных исследованиях.
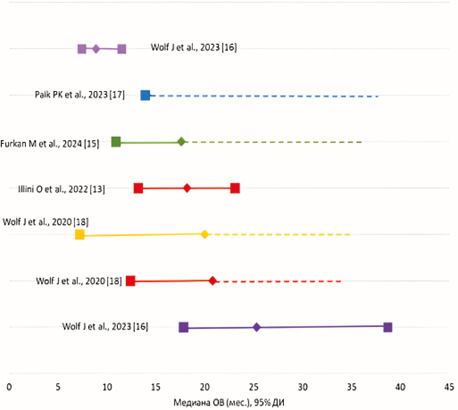
Рис. 5. Результаты наивного сравнения различных режимов лечения НМРЛ с мутацией в гене МЕТ по критерию «медиана общей выживаемости» (мес.)
Fig. 5. Results of a naive comparison of different treatment regimens for NSCLC with a mutation in the MET gene according to the criterion “median overall survival” (months)
Как видно из данных, представленных на рис. 5, применение капматиниба характеризуется тенденцией к более длительной медиане ОВ, в тоже время оценить статистическую достоверность различий невозможно по причине дизайна исследований реальной клинической практики.
Обсуждение / Discussion
В настоящем исследование был проведен обзор исследований реальной клинической практики (РКП; Real-World Data; RWD) применения капматиниба при раке лёгкого с мутацией МЕТ. Была предпринята попытка осуществить сравнение эффективности капматиниба с иными режимами лекарственной терапии рака лёгкого с мутацией MET. Основным ограничение стало малое количество клинических исследований, а также исследований реальной клинической практики и разнородность групп сравнения, которые включались в опубликованные сравнительные исследования. Эти ограничения не позволили выполнить полноценный метаанализа, поэтому по ряду критериев эффективности были проведены наивные сравнения без указания статистической достоверности наблюдаемых различий.
По так называемым «суррогатным» критериям эффективности (ЧОО и уровень контроля над заболеванием) удалось выполнить метаанализ имеющихся исследований, который показал, что капматиниб характеризуется больше эффективностью в сравнении с другими режимами лекарственного лечения, в том числе иммунотерапии.
По так называемым «твердым» исходам, к которым относятся ВБП и ОВ, выполнить метаанализ не удалось по причине вышеописанных ограничений. Наивное сравнение показало большую эффективность капматиниба.
Полученные результаты в целом близки к результатам контролируемого исследования капматиниба GEOMETRY mono-1 [21].
Полученные в настоящем исследовании результаты в целом совпадают с данными Fraser М. et al. (2022 г.), которые также отметили, что результаты исследований РКП в целом согласуются с рандомизированными испытаниями [22].
Выводы / Conclusions
- Количество проведённых исследований реальной клинической практики различных режимов лечения немелкоклеточный рак лёгкого с мутацией МЕТ ограничено.
- Отобранные для анализа исследования характеризуются разнородным дизайном, хотя и имеет ряд общих критериев эффективности.
- По результатам выполненных метаанализов при сравнении капматиниба с иммунотерапией по критериям частота объективного ответа и «уровень контроля над заболеванием» ингибитор тирозинкиназы МЕТ демонстрирует большую эффективность.
- По критериям общая выживаемость и выживаемость без прогрессирования по результатам наивного сравнения применение капматиниба характеризуется большей эффективностью.
Список литературы
1. Клинические рекомендации Минздрава России. Злокачественные новообразования бронхов и лёгкого. Электронный ресурс. https://cr.minzdrav.gov.ru/recomend/30_4
2. Злокачественные новообразования в России в 2022 году (заболеваемость и смертность) / под ред. А.Д. Каприна и др.] – М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2023. – ил. – 275 с.
3. Состояние онкологической помощи населению России в 2022 году. Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2022. – ил. – 239 с.
4. NCCN Clinical Practice Guidelines in Oncology, Non-Small Cell Lung Cancer. Version 5.2024 – April 23, 2024. Электронный ресурс. https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf.
5. Vuong HG, Ho ATN, Altibi AMA, Nakazawa T, Katoh R, Kondo T. Clinicopathological implications of MET exon 14 mutations in non-small cell lung cancer – A systematic review and meta-analysis. Lung Cancer. 2018 Sep;123:76-82. doi: 10.1016/j.lungcan.2018.07.006. Epub 2018 Jul 6. PMID: 30089599.
6. Huang C, Zou Q, Liu H, Qiu B, Li Q, Lin Y, Liang Y. Management of Non-small Cell Lung Cancer Patients with MET Exon 14 Skipping Mutations. Curr Treat Options Oncol. 2020 Apr 18;21(4):33. doi: 10.1007/s11864-020-0723-5.
7. Guo R, Luo J, Chang J, Rekhtman N, Arcila M, Drilon A. MET-dependent solid tumours – molecular diagnosis and targeted therapy. Nat Rev Clin Oncol. 2020 Sep;17(9):569-587. doi: 10.1038/s41571-020-0377-z.
8. Tong JH, Yeung SF, Chan AW, Chung LY, Chau SL, Lung RW, Tong CY, Chow C, Tin EK, Yu YH, Li H, Pan Y, Chak WP, Ng CS, Mok TS, To KF. MET Amplification and Exon 14 Splice Site Mutation Define Unique Molecular Subgroups of Non-Small Cell Lung Carcinoma with Poor Prognosis. Clin Cancer Res. 2016 Jun 15;22(12): 3048-56. doi: 10.1158/1078-0432.CCR-15-2061.
9. Yeung SF, Tong JHM, Law PPW, Chung LY, Lung RWM, Tong CYK, Chow C, Chan AWH, Wan IYP, Mok TSK, To KF. Profiling of Oncogenic Driver Events in Lung Adenocarcinoma Revealed MET Mutation as Independent Prognostic Factor. J Thorac Oncol. 2015 Sep;10(9):1292-1300. doi: 10.1097/JTO.0000000000000620.
10. Awad MM, Oxnard GR, Jackman DM, Savukoski DO, Hall D, Shivdasani P, Heng JC, Dahlberg SE, Jänne PA, Verma S, Christensen J, Hammerman PS, Sholl LM. MET Exon 14 Mutations in Non-Small-Cell Lung Cancer Are Associated With Advanced Age and Stage-Dependent MET Genomic Amplification and c-Met Overexpression. J Clin Oncol. 2016 Mar 1;34(7):721-30. doi: 10.1200/JCO.2015.63.4600.
11. Hong L, Zhang J, Heymach JV, Le X. Current and future treatment options for MET exon 14 skipping alterations in non-small cell lung cancer. Ther Adv Med Oncol. 2021 Feb 15;13:1758835921992976. doi: 10.1177/1758835921992976.
12. Vuong HG, Ho ATN, Altibi AMA, Nakazawa T, Katoh R, Kondo T. Clinicopathological implications of MET exon 14 mutations in non-small cell lung cancer – A systematic review and meta-analysis. Lung Cancer. 2018 Sep;123:76-82. doi: 10.1016/j.lungcan.2018.07.006.
13. Illini O, Fabikan H, Swalduz A, Vikström A, Krenbek D, Schumacher M, Dudnik E, Studnicka M, Öhman R, Wurm R, Wannesson L, Peled N, Kian W, Bar J, Daher S, Addeo A, Rotem O, Pall G, Zer A, Saad A, Cufer T, Sorotsky HG, Hashemi SMS, Mohorcic K, Stoff R, Rovitsky Y, Keren-Rosenberg S, Winder T, Weinlinger C, Valipour A, Hochmair MJ. Real-world experience with capmatinib in MET exon 14-mutated non-small cell lung cancer (RECAP): a retrospective analysis from an early access program. Ther Adv Med Oncol. 2022 Jun 13;14:17588359221103206. doi: 10.1177/17588359221103206.
14. Asad Zadeh Vosta Kolaei F, Cai B, Kanakamedala H, Kim J, Doban V, Zhang S, Shi M. Biomarker Testing Patterns and Treatment Outcomes in Patients With Advanced Non-Small Cell Lung Cancer and MET Exon 14 Skipping Mutations: A Descriptive Analysis From the US. Front Oncol. 2022 Feb 25;12:786124. doi: 10.3389/fonc.2022.786124.
15. Furqan M, Karanth S, Goyal RK, Cai B, Rombi J, Davis KL, Caro N, Saliba T. Effectiveness of standard treatments in non-small-cell lung cancer with METexon14 skipping mutation: a real-world study. Future Oncol. 2024;20(22):1553-1563. doi:10.2217/fon-2023-1064.
16. Wolf J, Souquet PJ, Goto K, et al. Improved Survival Outcomes in Patients With MET-Dysregulated Advanced NSCLC Treated With MET Inhibitors: Results of a Multinational Retrospective Chart Review. Clinical Lung Cancer. 2023 Nov; 24(7):641-650.e2. DOI: 10.1016/j.cllc.2023.08.011.
17. Paik PK, Goyal RK, Cai B, Price MA, Davis KL, Ansquer VD, Caro N, Saliba TR. Real-world outcomes in non-small-cell lung cancer patients with MET Exon 14 skipping mutation and brain meta-stases treated with capmatinib. Future Oncol. 2023 Jan;19(3):217-228. doi: 10.2217/fon-2022-1133.
18. Wolf J, et al. 1346P Comparison of clinical outcomes of patients with METΔex14 NSCLC treated with first-line capmatinib in the GEOMETRY mono-1 study with those of a cohort of real-world patients. Annals of oncology. Volume 31, S863, DOI: 10.1016/j.annonc.2020.08.1660.
19. Wolf J, Garon EB, Groen HJM, Tan DSW, Gilloteau I, Le Mouhaer S, Hampe M, Cai C, Chassot-Agostinho A, Reynolds M, Sherif B, Heist RS. Patient-reported outcomes in capmatinib-treated patients with METex14-mutated advanced NS-CLC: Results from the GEOMETRY mono-1 study. Eur J Cancer. 2023 Apr;183:98-108. doi: 10.1016/j.ejca.2022.10.030.
20. Babey H, Jamme P, Curcio H, Assié JB, Veillon R, Doubre H, Pérol M, Guisier F, Huchot E, Decroisette C, Falchero L, Corre R, Cortot A, Chouaïd C, Descourt R. Real-World Treatment Outcomes of MET Exon14 Skipping in Non-small Cell Lung Cancer: GFPC 03-18 Study. Target Oncol. 2023 Jul;18(4):585-591. doi: 10.1007/s11523-023-00976-4.
21. Wolf J, Seto T, Han JY, Reguart N, Garon EB, Groen HJM, Tan DSW, Hida T, de Jonge M, Orlov SV, Smit EF, Souquet PJ, Vansteenkiste J, Hochmair M, Felip E, Nishio M, Thomas M, Ohashi K, Toyozawa R, Overbeck TR, de Marinis F, Kim TM, Laack E, Robeva A, Le Mouhaer S, Waldron-Lynch M, Sankaran B, Balbin OA, Cui X, Giovannini M, Akimov M, Heist RS; GEOMETRY mono-1 Investigators. Capmatinib in MET Exon 14-Mutated or MET-Amplified Non-Small-Cell Lung Cancer. N Engl J Med. 2020 Sep 3;383(10):944-957. doi: 10.1056/NEJ-Moa2002787.
22. Fraser M, Seetharamu N, Diamond M, Lee CS. Profile of Capmatinib for the Treatment of Metastatic Non-Small Cell Lung Cancer (NSCLC): Patient Selection and Perspectives. Cancer Manag Res. 2023 Nov 3;15:1233-1243. doi: 10.2147/CMAR.S386799.
Об авторах
А. А. КурылевРоссия
Курылев Алексей Александрович — к. м. н., доцент кафедры клинической фармакологии и доказательной медицины
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов.
А. С. Колбин
Россия
Колбин Алексей Сергеевич — д. м. н., профессор, зав. кафедрой клинической фармакологии и доказательной медицины; профессор кафедры фармакологии медицинского факультета
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов.
И. Р. Свечкарева
Россия
Свечкарева Изабелла Размиковна — ординатор кафедры клинической фармакологи и доказательной медицины
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликтов интересов.
Рецензия
Для цитирования:
Курылев А.А., Колбин А.С., Свечкарева И.Р. Обзор исследований реальной клинической практики применения капматиниба при раке лёгкого с мутацией МЕТ. Реальная клиническая практика: данные и доказательства. 2025;5(1):3-12. https://doi.org/10.37489/2782-3784-myrwd-064. EDN: LWCLXM
For citation:
Kurylev A.A., Kolbin A.S., Svechkareva I.R. Review of real-world studies on capmatinib use in MET-mutated lung cancer. Real-World Data & Evidence. 2025;5(1):3-12. (In Russ.) https://doi.org/10.37489/2782-3784-myrwd-064. EDN: LWCLXM
JATS XML






























