ОЦЕНКА ТЕХНОЛОГИЙ ЗДРАВООХРАНЕНИЯ
Данные исследований реальной клинической практики применяют при регистрации лекарственных средств, при изучении сравнительной эффективности и безопасности, для изменения инструкций по медицинскому применению, формированию клинических рекомендаций. Ещё одним вариантом применения исследований RWD/RWE является оценка технологий здравоохранения. Несмотря на совершенно ясную необходимость в качественных рекомендациях по проведению исследований реальной клинической практики, опубликованные на сегодняшний день руководства не содержат подробных инструкций и носят рекомендательный характер.
МЕТОДОЛОГИЯ
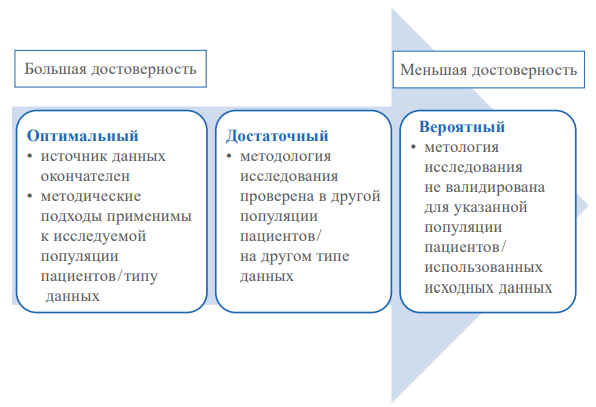
В последние годы разработка методологии получения доказательств клинической эффективности и безопасности медицинских технологий на основе сбора и анализа данных реальной клинической практики (real-world data; RWD, и real-world evidence; RWE) становится крайне актуальной. Методология RWD / RWE предполагает использование различных видов исследований, что определяет наличие как преимуществ, так и недостатков, что требует разработки как единой методологии проведения подобных исследований, так и подходов к оценке достоверности их результатов. Одним из таких направлений является ранжирование достоверности результатов исследований на основе оценки качества исходных данных: популяции пациентов, воздействий, исходов — и конфаундинга факторов (вмешивающихся факторов). Оптимальная оценка уровня достоверности достигается в случае наличия подробного описания использованных источников данных; методик, применённых при их обработке.
Международное общество фармакоэпидемиологии (ISPE) и Международное общество фармакоэкономических исследований и научного анализа исходов (ISPOR) создали совместную рабочую группу, включающую представителей ключевых международных заинтересованных сторон, чтобы разработать согласованный шаблон протокола для исследований реальной клинической практики (RWE), которые оценивают эффект лечения и предназначены для принятия взвешенных, обоснованных решений. Шаблон основан на существующих действиях по повышению прозрачности и включает в себя новейшие идеи относительно уровня детализации, необходимого для обеспечения воспроизводимости исследования RWE. Основополагающий принцип заключался в достижении достаточной чёткости в отношении данных, дизайна исследования и анализа результатов для достижения 3 основных целей. Во-первых, помочь исследователям тщательно продумать, а затем задокументировать выбор и обоснование ключевых параметров исследования. Во-вторых, улучшить принятие решений, позволяя экспертам легко оценивать потенциальные отклонения, связанные с этим выбором, и, в-третьих, облегчить воспроизводимость результатов исследований.
МЕЖДУНАРОДНЫЙ ОПЫТ
Растущий объём и сложность данных, которые в настоящее время собираются в различных условиях и с разных устройств, имеют различную степень и качество, что ставит перед здравоохранением задачу для создание устойчивой электронной системы, позволяющей собирать, анализировать и обеспечивать к ним доступ клиницистов. Создание системы, развитие возможностей и потенциала информационных технологий для получения, управления и анализа большого массива данных позволит выявлять факты, касающиеся безопасности и эффективности применения лекарственных средств, исследовать обоснованность заявлений, сделанных фармакологическими компаниями, получать более точную характеристику методов лечения в отдельных отраслях здравоохранения и обеспечить быстрый и постоянный доступ врачей к данной информации, что облегчит её применение при лечении пациентов. Разработка такого инструмента является приоритетной задачей системы здравоохранения в меняющемся мире. Примером такого инструмента является сеть анализа данных и опроса в реальном мире DARWIN EU® (Data Analysis and Real World Interrogation Network), создание которой было инициировано 9 февраля 2022 года Европейским агентством лекарственных средств (European Medicines Agency). Целью данной статьи является просмотр истории создания, организационной структуры, принципов работы, текущего опыта регуляторной сети Европейского союза и сравнение с опытом международных регулирующих органов. В статье наряду с опытом Европейского агентства лекарственных средств также рассматриваются аналогичные инициативы США и Канады.
В данной статье представлен краткий обзор ключевых аспектов планирования, проведения и представления результатов исследований по сбору и анализу данных реальной клинической практики NICE, а также общая информация об источниках данных реальной клинической практики и их использовании в алгоритмах принятия управленческих решений организацией NICE. Описаны трудности поиска и использования данных реальной клинической практики, а также методы их преодоления, даны краткие рекомендации NICE по оценке пригодности данных и алгоритм проведения количественных исследований по сбору доказательств реальной клинической практики.