ОЦЕНКА ТЕХНОЛОГИЙ ЗДРАВООХРАНЕНИЯ
Определение эффективности лекарственного препарата — сложный процесс. В настоящее время стандартным методом определения эффективности использования медицинского вмешательства является «год жизни с поправкой на качество» (QALY; quality adjusted life-years). Летом 2024 было опубликовано описание нового метода оценки эффективности медицинских вмешательств — SoLV (Standard of Living Valuation; оценка исходя из уровня жизни). Этот недавно разработанный метод сложнее, чем QALY, но возможности его шире. Однако этот метод так же не является исчерпывающим. Проблема создания оптимального метода оценки экономической эффективности технологий здравоохранения остаётся открытой.
Биоаналоги сталкиваются со значительными проблемами при оценке их стоимости. Быстрое развитие данного направления фармацевтической индустрии требует переосмысления экономической оценки препаратов и оптимизации регуляторных процедур.
БЕЗОПАСНОСТЬ ЛЕКАРСТВ
Актуальность. Применение антикоагулянтов во время беременности является довольно распространённой практикой. В связи с широким применением пероральных антикоагулянтов в реальной клинической практике и высокой частотой незапланированного наступления беременности врач может столкнуться с необходимостью оценить риски и спланировать тактику ведения беременности.
Цель. Целью настоящего анализа было оценить юридические предпосылки и фактические данные о рисках, связанных с применением пероральных антикоагулянтов у беременных в реальной клинической практике.
Материалы и методы. Произведён анализ официальных инструкций по применению зарегистрированных в России пероральных антикоагулянтов, анализ опубликованной литературы о репродуктивной токсичности и практике применения препаратов во время беременности, общий сравнительный анализ преобладания отдельных пероральных антикоагулянтов в практическом здравоохранении в России.
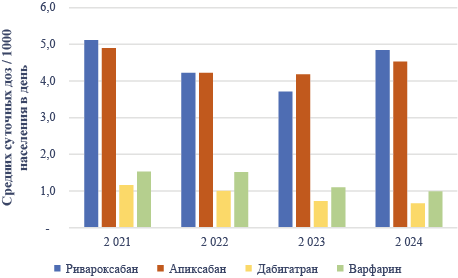
Результаты. В результате анализа выявлена высокая вариабельность в части ограничений для применения во время беременности различных пероральных антикоагулянтов. При этом фактические свидетельства о репродуктивной токсичности для препаратов существенно не различаются и свидетельствуют об отсутствии сигналов о потенциальной тератогенности как минимум на основании имеющегося числа наблюдений. Максимальное число наблюдений беременности, превышающее число наблюдений на фоне приёма варфарина, опубликовано на фоне применения ривароксабана (505 случаев в самом крупном анализе). Остальные представители описаны несколькими десятками наблюдений. Практика структуры применения пероральных антикоагулянтов в России также создаёт предпосылки для более вероятного применения ривароксабана и апиксабана на фоне незапланированной беременности.
Выводы. В настоящее время в реальной клинической практике имеются предпосылки для наступления беременности на фоне терапии новыми пероральными антикоагулянтами, что требует принятия решения о тактике ведения беременности. Инструкции по применению препаратов не содержат обоснованной информации и формулировок для принятия решений, основанных на накопленных знаниях о репродуктивной токсичности. На основании опубликованных данных об использовании препаратов этой группы во время беременности в реальной клинической практике не складывается представления о тератогенном потенциале для всех представителей за исключением варфарина, при этом наибольшее число наблюдений касается наиболее часто применяющегося ривароксабана.
ТЕХНОЛОГИИ ЦИФРОВОГО ЗДРАВООХРАНЕНИЯ
Настоящая статья посвящена изучению и анализу электронных медицинских карт (ЭМК), которые представляют собой основной инструмент в сфере цифрового здравоохранения. ЭМК обеспечивают более быструю и эффективную передачу медицинской информации между различными учреждениями и специалистами, что способствует улучшению качества оказания медицинской помощи. В статье рассматриваются различные аспекты внедрения и использования ЭМК, включая технические трудности, вопросы конфиденциальности данных и их безопасности. Особое внимание уделяется влиянию ЭМК на процессы диагностики и лечения, а также на взаимодействие между пациентами и специалистами здравоохранения. Основываясь на обзоре текущих исследований и практических примеров, авторы предлагают рекомендации по оптимизации использования ЭМК в медицинских учреждениях. В заключение обсуждаются перспективы дальнейшего развития технологий электронных медицинских карт и их роль в трансформации современной медицины.
ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
На сегодняшний день золотым стандартом для представления доказательств эффективности и безопасности медицинских манипуляций являются рандомизированные контролируемые исследования (РКИ). Для того чтобы результаты исследований были доступны другим специалистам и имели потенциальный вес в научном сообществе, они должны быть описаны и опубликованы в соответствии с общепринятыми международными стандартами, CONSORT, или Consolidated standards of reporting trials.
Цель: проанализировать качество представления результатов клинических исследований в РФ в соответствии со стандартами CONSORT.
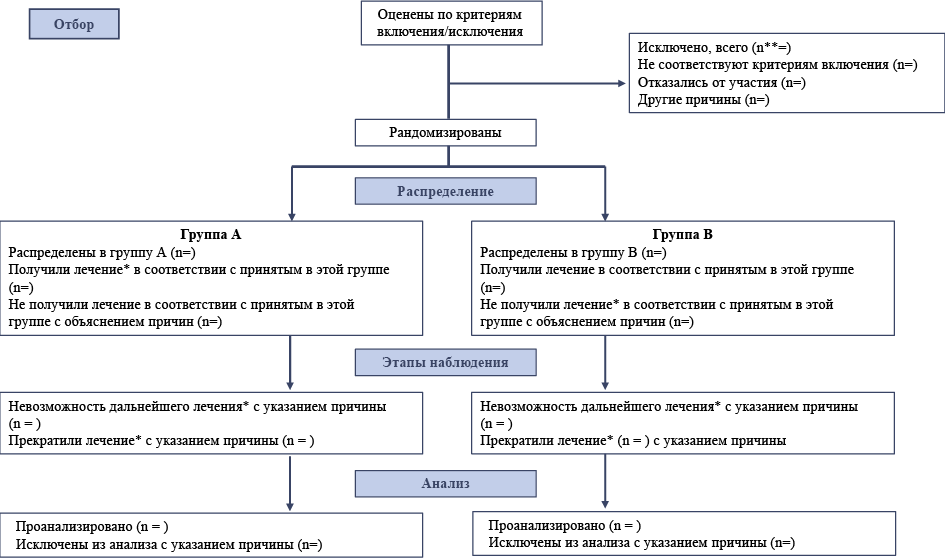
Материалы и методы. Для исследования были выбраны российские журналы: «Научно-практическая ревматология», «Качественная клиническая практика», «Социальная и клиническая психиатрия», «Журнал неврологии и психиатрии им. С. С. Корсакова». Выбор целевых журналов происходил по двум основным показателям рейтинга журнала в РИНЦ; согласно рейтингу SCIENCE INDEX и рейтингу психиатрических журналов по импакт-фактору РИНЦ 2016. Были выбраны журналы из области биомедицины («Научно-практическая ревматология»), журнал по клинической фармакологии («Качественная клиническая практика») и журналы из области психологии и психиатрии («Социальная и клиническая психиатрия», «Журнал неврологии и психиатрии им. С. С. Корсакова»). Каждая статья оценивалась согласно пунктам чек-листа CONSORT и отмечалось наличие или отсутствие данных по представленным пунктам. При изучении статей анализировали также наличие или отсутствие в статье блок-схемы, которая значительно повышает качество написанной статьи, и соответствие международным стандартам оформления статей для медицинских журналов.
Результаты. Проанализированные статьи с результатами РКИ в журналах соответствовали большинству необходимых критериев. Меньше всего авторы при публикации обращают внимание на такие детали методики, как описание расчёта выборки (2 из 5 публикаций), вид проводимой рандомизации (2 из 5 публикации), механизм ослепления участников (3 из 5 публикации), осуществление и маскирование (1 из 5 публикаций). Недоступность для читателя этой информации может исказить его восприятие и доверие к результатам, полученным в исследовании.
Заключение. Полученные результаты показывают, что рассмотренные российские медицинские журналы декларируют требования и рекомендации для публикации статей в соответствии со стандартами CONSORT. Чтобы повысить доверие читателей к практической и научной значимости проводимых РКИ, необходимо учитывать требования CONSORT и стремиться им следовать.
ОБРАЗОВАНИЕ
В статье описывается важность фармакоэпидемиологических исследований по оценке знаний и предпочтений специалистов. Описывается опыт автора в организации и проведении исследований данного типа, даётся обоснование термина «образовательная фармакоэпидемиология» (ОФЭ) и приводится информация о создании первой лаборатории ОФЭ. В контексте таких важных направлений доказательной медицины, как «данные реальной клинической практики» (Real-World Data; RWD) и «доказательства, полученные на основе анализа данных реальной клинической практики» (Real-World Evidence; RWE), обосновывается введение в научных обиход такого связующего термина, как «знания из реальной практики» или «практические знания» (Real-World Knowledge; RWK).
РЕЦЕНЗИЯ
Вышло в свет 2-е исправленное и дополненное издание «Фармаконадзор». В данной книге с позиции клинической фармакологии обсуждаются вопросы безопасности лекарственной терапии и система фармаконадзора. Подробно приведена история изучения безопасности лекарств. Даны основные определения и классификации нежелательных явлений. Отдельной главой рассмотрена система фармаконадзора в государствах — членах ЕАЭС. Монография предназначена для студентов медицинских вузов, ординаторов, аспирантов, клинических фармакологов и врачей других специальностей, держателей регистрационных удостоверений, врачей-исследователей.