2025-12-27
Качество данных в разработке лекарств: недостающий фундамент для реализации потенциала ИИ в клинических испытаниях
 | Трансформационный потенциал искусственного интеллекта (ИИ) в клинических исследованиях упирается в фундаментальную и часто игнорируемую проблему — качество и гармонизацию данных. В эпоху персонализированной медицины и взрывного роста объёмов информации (от носимых устройств до электронных медицинских карт) фрагментированные экосистемы данных становятся основным операционным барьером. |
2025-12-27
Использование реальных данных в регулировании медицинских изделий: новый этап с выпуском руководства FDA 2025 года
 | В декабре 2025 года FDA выпустило финальное обновленное руководство «Use of Real-World Evidence to Support Regulatory Decision-Making for Medical Devices». Этот документ знаменует собой новый этап в интеграции данных реальной клинической практики в процессы одобрения и мониторинга медицинских изделий. Статья анализирует ключевые положения руководства, его отличия от предыдущей версии 2017 года и практические последствия для производителей и исследователей. |
2025-12-24
Руководство FDA по использованию данных RWE для поддержки принятия регуляторных решений в отношении медицинских изделий
 | FDA завершило разработку руководства по использованию данных из реальной клинической практики (RWE) для поддержки принятия регуляторных решений в отношении медицинских изделий, заменив свою структуру 2017 года и завершив проект руководства 2023 года. |
2025-12-21
Школа RWD / RWE
 | Уже третий раз на базе кафедры клинической фармакологии и доказательной медицины "Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова" была проведена Образовательная программа дополнительного профессионального образования «Реальная клиническая практика: данные и доказательства» (Школа RWD / RWE). |
2025-12-19
FDA убирает ключевое препятствие для использования реальных данных
 | FDA официально разрешило использовать обезличенные данные пациентов из реальной клинической практики при подаче заявок на регистрацию медицинских изделий (а в перспективе — и лекарств). Это историческое изменение политики, принятое 15 декабря 2025 года. |
2025-12-12
Рецензия на книгу «Руководство по этике научных исследований» / под общей ред. А.Л. Хохлова. — М.: Изд-во ОКИ, 2026. — 764 с.
 | Для научного сообщества, ориентированного на исследования реальной клинической практики (Real-World Data/Evidence; RWD/RWE), выход фундаментального «Руководства по этике научных исследований» под редакцией академика РАН А.Л. Хохлова — событие не просто значимое, а стратегически важное. |
2025-12-11
Обзор новостей в области RWD / RWE за ноябрь 2025 г.
 | Публикуем новости в мире и в РФ в области данных реального мира (RWD) и фактических данных реального мира (RWE) за ноябрь 2025 года. |
2025-12-08
18–19 ноября 2025 г. в Сингапуре состоялось очное заседание Ассамблеи Международного совета по гармонизации (ICH)
 | В рамках которой параллельно проходили совещания 12 рабочих групп. В качестве новых членов ICH в заседании приняли участие Управление по контролю качества пищевых продуктов и лекарственных средств Нигерии (NAFDAC) и Южноафриканский орган по регулированию товаров медицинского назначения (SAHPRA), а в качестве новых наблюдателей – Главное управление по контролю качества лекарственных средств, пищевых продуктов и товаров медицинского назначения Доминиканской Республики (DIGEMAPS) и Управление по контролю качества пищевых продуктов и лекарственных средств (FDA) Филиппин. |
2025-12-05
На сайте ВОЗ опубликован новый документ «Глобальная стратегия интеллектуального фармаконадзора»
 | В ноябре 2025 года ВОЗ опубликовала документ «Глобальная стратегия интеллектуального фармаконадзора» (The global smart pharmacovigilance strategy). Стратегия ВОЗ задает рамки для построения и усиления национальных систем мониторинга безопасности с учетом разных уровней развития здравоохранения. |
2025-11-27
Наследственные патологии: как сделать их поиск частью повседневной практики педиатра
 | Наследственные заболевания могут проявляться с первых дней жизни ребенка, начиная от малых отклонений развития до угрожающих нарушений в работе сердца и дыхательной системы. Об этих симптомах, позволяющих диагностировать редкие и тяжелые заболевания, рассказали эксперты НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б. В. Петровского» в ходе онлайн-конференции «Редкие заболевания в педиатрии: от симптома к системе» 18-19 ноября 2025 г. Организатором мероприятия выступил проект «Помощь редким». |
2025-11-26
Пилотная программа оценки комплексной ценности медицинского страхования на основе реальной клинической практики
 | Недавно Канцелярия Государственного управления медицинского страхования КНР выпустила «Уведомление о запуске пилотной программы оценки комплексной ценности медицинского страхования на основе реальной клинической практики» (№ 15, 2025), в котором принято решение о запуске пилотной программы в 11 провинциях и городах, включая Пекин и провинцию Хайнань. Эта пилотная инициатива знаменует собой выход управления медицинским страхованием Китая на новый этап: переход от решения задачи «обеспечения доступности» к решению задачи «повышения качества», используя данные реальной клинической практики для создания «точного профиля» фармацевтической продукции. |
2025-11-19
Российский биоаналог пембролизумаба показал эффективность в реальной клинической практике на Кубе
 | Российский биоаналог пембролизумаба (BCD-201), разработанный биотехнологической компанией BIOCAD, показал благоприятный профиль безопасности и эффективности в реальной клинической практике у пациентов с метастатической и неоперабельной меланомой. Данные получены в ходе наблюдательного исследования, которое проводилось в трёх крупнейших онкологических центрах Кубы с января по июль 2024 года. Данные представлены на международном онкологическом конгрессе ESMO в Берлине 20 октября 2025 года. |
2025-11-12
Обзор новостей в области RWD / RWE за октябрь 2025 г.
 | Публикуем новости в мире и в РФ в области данных реального мира (RWD) и фактических данных реального мира (RWE) за октябрь 2025 года. |
2025-11-12
Персональные данные в RWE-исследованиях: грядут большие перемены?
 | RWE-исследования, особенно основанные на вторичном использовании данных медицинских карт и регистров, упираются в серьезный барьер — техническую сложность получения согласия граждан на обработку их персональных данных и правовую неопределенность самого процесса обработки. |
2025-11-12
FDA использовала данные реальной клинической практики для подтверждения эффективности по препарату Vijoice® (алпелисиб / alpelisib)
 | Vijoice был одобрен FDA в апреле 2022 года для лечения пациентов с тяжёлыми формами синдрома избыточного роста, связанными с мутацией PIK3CA (PROS). |
2025-11-09
Проект руководства под названием «Методы сбора данных о безопасности и эффективности продуктов клеточной и генной терапии на пострегистрационном этапе»
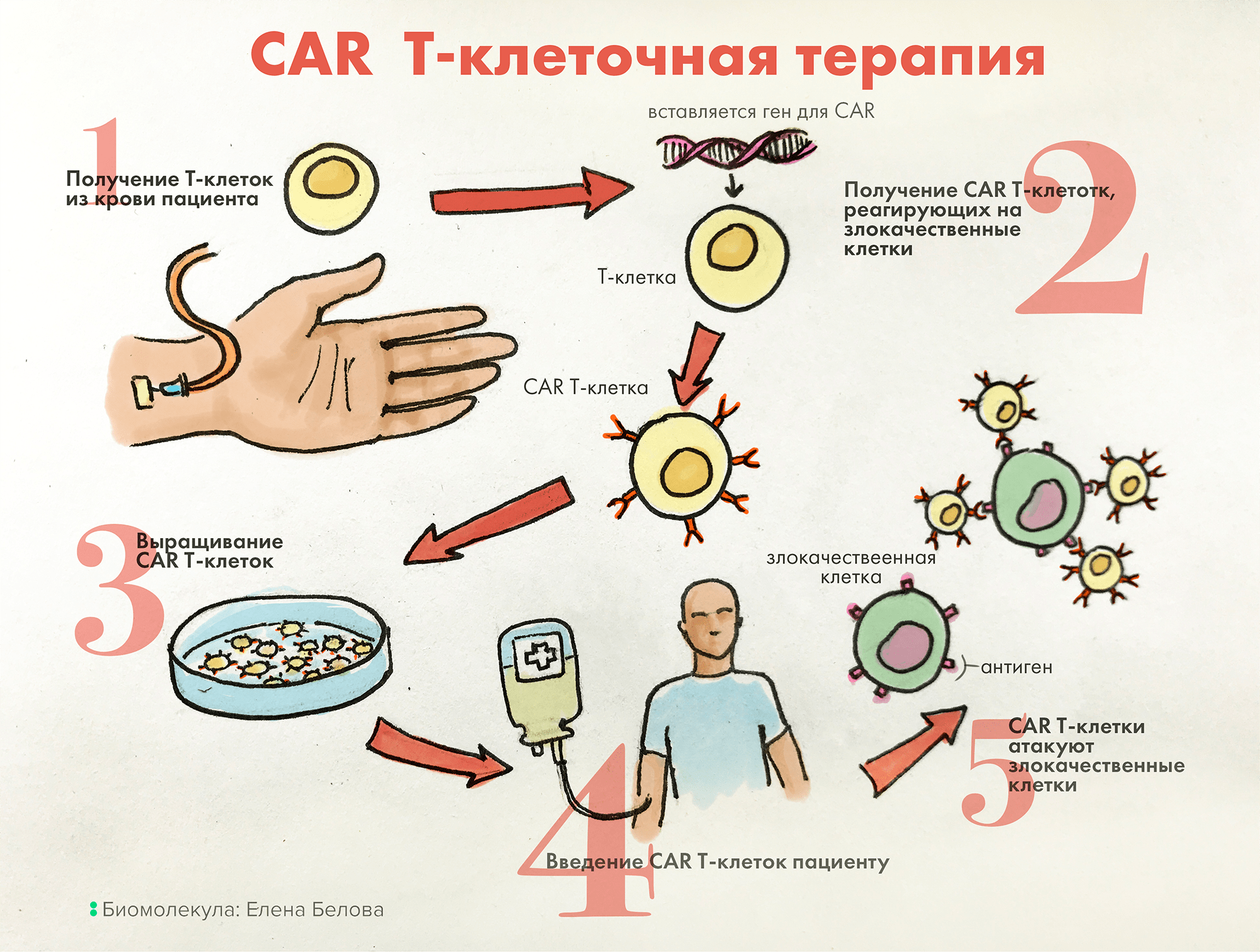 | FDA опубликовало проект руководства под названием «Методы сбора данных о безопасности и эффективности продуктов клеточной и генной терапии на пострегистрационном этапе», в котором разъясняется, как спонсорам следует собирать пострегистрационные данные, используя RWD, методы сбора данных за пределами традиционных клинических испытаний. |
2025-10-30
Европейская комиссия приняла окончательный вариант правила совместной клинической оценки (JCA) медицинских изделий и медицинских изделий для диагностики in vitro
 | Эта мера знаменует собой завершение формирования нормативной базы, необходимой для обеспечения единообразной и основанной на фактических данных оценки медицинских технологий на всей территории ЕС. |
2025-10-28
Интервью со спикерами VI конференции с международным участием: «Реальная клиническая практика. Возможное и реальное», Москва, 25 сентября 2025 года
2025-10-28
«Редкие заболевания в педиатрии: от симптома к системе»: 18-19 ноября 2025 эксперты обсудят внедрение принципов орфанного поиска в работу детских врачей
 | Редкие заболевания были и остаются вызовом, требующим от педиатра развитого клинического мышления и большой медицинской эрудиции. Тем не менее, современные представления о редких болезнях уже позволяют перейти от рассмотрения отдельных симптомов к системному взгляду на проблему — и органично внедрить принципы орфанного поиска в повседневную работу детского врача. |
2025-10-24
Развитие рынка медицинских данных в России требует особой модели регулирования
 | Ассоциация больших данных (АБД) разработала функциональную модель оценки риска при обмене чувствительными данными, включая медицинские данные, и занимается формированием стандартов в области риск-ориентированного подхода, рассчитывая на реализацию в России пилотных проектов по внедрению таких подходов. Об этом на сессии «Кибербезопасность в эпоху больших медицинских данных» форума «Национальное здравоохранение – 2025» сообщила директор по стратегическим проектам АБД Ирина Левова. |
2025-10-23
Методы сбора данных о безопасности и эффективности продуктов клеточной и генной терапии на пострегистрационном этапе
 | FDA опубликовало проект руководства под названием «Методы сбора данных о безопасности и эффективности продуктов клеточной и генной терапии на пострегистрационном этапе», в котором разъясняется, как спонсорам следует собирать пострегистрационные данные, используя RWD, методы сбора данных за пределами традиционных клинических испытаний. |
2025-10-18
FDA представило обновлённый портал по доказательствам на основе реальных данных
 | В конце сентября 2025 года FDA запустило обновлённую версию своего портала о доказательствах, полученных на основе реальных данных (RWE), объединив в одном месте все действующие инициативы, программы и руководства, связанные с использованием реальных данных (RWD) и доказательств на их основе (RWE) в регуляторной практике. |
2025-10-15
FDA официально внедрила новую версию международных стандартов Good Clinical Practice — ICH E6(R3)
 | В сентябре 2025 года Управление по контролю за продуктами и лекарствами США (FDA) опубликовало финальное руководство E6(R3) Good Clinical Practice (GCP), тем самым утвердив его как национальный норматив для всех клинических исследований, проводимых под юрисдикцией США. Документ завершает переход от международного уровня к национальному: теперь все исследования, подаваемые в FDA, должны соответствовать именно версии R3. |
2025-10-14
Исследование ПРИОРИТЕТ-ХБП: важность своевременной диагностики хронической болезни почек у пациентов с артериальной гипертензией
 | 25-27 сентября 2025 г. в Казани на Российском национальном конгрессе кардиологов были представлены результаты промежуточного анализа исследования реальной клинической практики ПРИОРИТЕТ-ХБП. Данное многоцентровое исследование посвящено оценке частоты диагностирования хронической болезни почек (ХБП) у пациентов с АГ (артериальная гипертензия) и лабораторными признаками нарушения функции почек. |





























